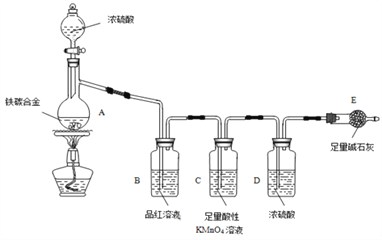
题目内容
【题目】某混合物A,含有KAl(SO4)2、Al2O3和Fe2O3,在一定条件下可实现下图所示的物质之间的变化:

据此回答下列问题:
(1)I、II、III、IV四步操作采取的分离方法是___________________。
(2)根据上述框图反应关系,写出下列B、C、E所含物质的化学式
沉淀固体B________________;C______________________;E_______________
(3)写出①、④四个反应方程式(是离子反应的写离子方程式)
①____________________________ ④__________________________
【答案】过滤 Al2O3 Al2O3、Fe2O3 K2SO4、(NH4)2SO4 (加上NH3·H2O不扣分) Al2O3+2OH- = 2AlO2- + H2O 2Al(OH)3![]() Al2O3+3H2O
Al2O3+3H2O
【解析】
本题考查化学工艺流程,(1)I、II、III、IV步得到溶液和沉淀,因此操作步骤是过滤;(2)KAl(SO4)2溶于水,Al2O3和Fe2O3不溶于水,即沉淀C为Al2O3和Fe2O3,溶液为KAl(SO4)2溶液,反应②发生Al3++3NH3·H2O=Al(OH)3↓+3NH4+,即溶液E为K2SO4、(NH4)2SO4和过量的NH3·H2O,沉淀是Al(OH)3,Al2O3属于两性氧化物,Fe2O3为碱性氧化物,沉淀C中加入NaOH溶液,发生Al2O3+2OH-=2AlO2-+H2O,沉淀D为Fe2O3,反应③发生AlO2-+H++H2O=Al(OH)3↓,反应④发生2Al(OH)3![]() Al2O3+3H2O,固体B为Al2O3;(3)根据上述分析,反应①的离子方程式为Al2O3+2OH-=2AlO2-+H2O,反应④的化学反应方程式为2Al(OH)3
Al2O3+3H2O,固体B为Al2O3;(3)根据上述分析,反应①的离子方程式为Al2O3+2OH-=2AlO2-+H2O,反应④的化学反应方程式为2Al(OH)3![]() Al2O3+3H2O。
Al2O3+3H2O。

 黄冈小状元解决问题天天练系列答案
黄冈小状元解决问题天天练系列答案 三点一测快乐周计划系列答案
三点一测快乐周计划系列答案