题目内容
【题目】生产中可用双氧水氧化法处理电镀含氰废水,某化学兴趣小组模拟该法探究有关因素对破氰反应速率的影响(注:破氰反应是指氧化剂将CN-氧化的反应)。
【相关资料】
①氰化物主要是以CN-和[Fe(CN)6]3-两种形式存在。
②Cu2+可作为双氧水氧化法破氰处理过程中的催化剂;Cu2+在偏碱性条件下对双氧水分解影响较弱,可以忽略不计。
③[Fe(CN)6]3-较CN-难被双氧水氧化,且pH越大,[Fe(CN)6]3-越稳定,越难被氧化。
【实验过程】
在常温下,控制含氰废水样品中总氰的初始浓度和催化剂Cu2+的浓度相同,调节含氰废水样品不同的初始pH和一定浓度双氧水溶液的用量,设计如下对比实验:
(1)请完成以下实验设计表(表中不要留空格)。
实验序号 | 实验目的 | 初始pH | 废水样品体积/mL | CuSO4溶液的体积/mL | 双氧水溶液的体积/mL | 蒸馏水的体积/mL |
① | 为以下实验操作参考 | 7 | 60 | 10 | 10 | 20 |
② | 废水的初始pH对破氰反应速率的影响 | 12 | 60 | 10 | 10 | 20 |
③ | ________ | 7 | 60 | ______ | ______ | 10 |
实验测得含氰废水中的总氰浓度(以CN-表示)随时间变化关系如图所示。
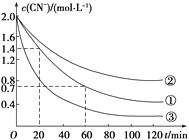
(2)实验①中20~60 min时间段反应速率:v(CN-)=______mol·L-1·min-1。
(3)实验①和实验②结果表明,含氰废水的初始pH增大,破氰反应速率减小,其原因可能是____________________(填一点即可)。在偏碱性条件下,含氰废水中的CN-最终被双氧水氧化为HCO,同时放出NH3,试写出该反应的离子方程式:____________。
(4)该兴趣小组同学要探究Cu2+是否对双氧水氧化法破氰反应起催化作用,请你帮助他们设计实验并验证上述结论,完成下表中内容(已知:废水中的CN-浓度可用离子色谱仪测定) ______。
实验步骤(不要写出具体操作过程) | 预期实验现象和结论 |
【答案】 双氧水的浓度对破氰反应速率的影响 10 20 0.017 5 初始pH增大,催化剂Cu2+会形成Cu(OH)2沉淀,影响了Cu2+的催化作用(或初始pH增大,[Fe(CN)6]3-较中性和酸性条件下更稳定,难以氧化) CN-+H2O2+H2O===NH3↑+HCO
实验方案(不要求写出具体操作过程) | 预期实验现象和结论 |
分别取等体积、等浓度的含氰废水于甲、乙两支试管中,再分别加入等体积、等浓度的双氧水溶液,只向甲试管中加入少量的无水硫酸铜粉末,用离子色谱仪测定相同反应时间内两支试管中的CN-浓度 | 相同时间内,若甲试管中的CN-浓度小于乙试管中的CN-浓度,则Cu2+对双氧水破氰反应起催化作用;若两试管中的CN-浓度相同,则Cu2+对双氧水破氰反应不起催化作用 |
【解析】(1)影响该反应的因素有pH以及双氧水的浓度,实验目的为废水的初始pH对破氰反应速率的影响和双氧水的浓度对破氰反应速率的影响,其他量应不变,而且总体积不变,所以CuSO4溶液的体积为10 mL,双氧水的体积为20 mL。(2)根据图像可知实验①中20~60 min时间段反应速率v(CN-)=![]() =0.017 5 mol·L-1·min-1。(3)pH越大,[Fe(CN)6]3-越稳定,越难被氧化,所以破氰反应速率减小;因为氰废水中的CN一最终被双氧水氧化为HCO3-,其中的碳由+2价变成+4价,1 mol CN-反应转移2 mol的电子,而1 mol过氧化氢得到2 mol的电子,所以CN一和H2O2的物质的量之比为1∶1,因此反应的离子方程式为CN-+H2O2+H2O===NH3↑+HCO3-。(4)要探究Cu2+是否对双氧水氧化法破氰反应起催化作用,其它条件应该是相同的,因此实验方案为:分别取温度相同、体积、浓度相同的含氰废水的试样两等份,滴加过氧化氢,一份中加入少量的无水硫酸铜粉末,另一份不加,用离子色谱仪测定相同反应时间内两支试管中的CN-浓度,如果在相同时间内,甲试管中的CN-浓度小于乙试管中的CN-浓度,则Cu2+对双氧水破氰反应起催化作用,反之则不起催化作用。
=0.017 5 mol·L-1·min-1。(3)pH越大,[Fe(CN)6]3-越稳定,越难被氧化,所以破氰反应速率减小;因为氰废水中的CN一最终被双氧水氧化为HCO3-,其中的碳由+2价变成+4价,1 mol CN-反应转移2 mol的电子,而1 mol过氧化氢得到2 mol的电子,所以CN一和H2O2的物质的量之比为1∶1,因此反应的离子方程式为CN-+H2O2+H2O===NH3↑+HCO3-。(4)要探究Cu2+是否对双氧水氧化法破氰反应起催化作用,其它条件应该是相同的,因此实验方案为:分别取温度相同、体积、浓度相同的含氰废水的试样两等份,滴加过氧化氢,一份中加入少量的无水硫酸铜粉末,另一份不加,用离子色谱仪测定相同反应时间内两支试管中的CN-浓度,如果在相同时间内,甲试管中的CN-浓度小于乙试管中的CN-浓度,则Cu2+对双氧水破氰反应起催化作用,反之则不起催化作用。

 天天向上口算本系列答案
天天向上口算本系列答案