题目内容
金属钛(Ti)性能优越,被称为继铁、铝后的“第三金属”.工业上以金红石为原料制取Ti的反应为:
aTiO2+bCl2+cC
aTiCl4+cCO 反应(1)
TiCl4+2Mg
Ti+2MgCl2 反应(2)
关于反应(1)、(2)的分析不正确的是( )
①TiCl4在反应(1)中是还原产物,在反应(2)中是氧化剂
②C、Mg在反应中均为还原剂,被还原
③在反应(1)、(2)中C的还原性大于TiCl4,Mg的还原性大于Ti
④a=1,b=c=2
⑤每生成9.6g Ti,反应(1)、(2)中共转移0.8mol e-.
aTiO2+bCl2+cC
| ||
TiCl4+2Mg
| ||
关于反应(1)、(2)的分析不正确的是( )
①TiCl4在反应(1)中是还原产物,在反应(2)中是氧化剂
②C、Mg在反应中均为还原剂,被还原
③在反应(1)、(2)中C的还原性大于TiCl4,Mg的还原性大于Ti
④a=1,b=c=2
⑤每生成9.6g Ti,反应(1)、(2)中共转移0.8mol e-.
分析:在化学反应中得电子化合价降低的物质是氧化剂,在反应中被还原;失电子化合价升高的物质是还原剂,在反应中被氧化;氧化剂对应的产物是还原产物,还原剂对应的产物是氧化产物;同一化学反应中还原剂的还原性大于还原产物的还原性;同一化学反应中反应前后遵循原子守恒定律.
解答:解:①aTiO2+bCl2+cC
aTiCl4+cCO,该反应中反应前后,碳元素的化合价升高,碳单质作还原剂,氯元素的化合价降低,氯气作氧化剂,还原产物是TiCl4;
TiCl4+2Mg
Ti+2MgCl2 该反应中钛元素的化合价降低,TiCl4作氧化剂;所以TiCl4在反应I中是还原产物,在反应II中是氧化剂,故正确;
②C、Mg在反应中反应前后化合价都升高,所以均为还原剂,被氧化,故错误;
③在反应I中C的还原性大于TiCl4;在反应II镁的还原性大于Ti,故正确.
④根据反应前后各元素的原子个数守恒知,
所以
,故正确;
⑤将方程式Ⅰ、Ⅱ相加得 TiO2+2Cl2+2C+2Mg=Ti+2CO+2MgCl2 转移电子
48g 8mol
9.6g 1.6mol
所以每生成9.6 g Ti,反应I、II中共转移1.6 mol e-,故错误.
故选D.
| ||
TiCl4+2Mg
| ||
②C、Mg在反应中反应前后化合价都升高,所以均为还原剂,被氧化,故错误;
③在反应I中C的还原性大于TiCl4;在反应II镁的还原性大于Ti,故正确.
④根据反应前后各元素的原子个数守恒知,
|
|
⑤将方程式Ⅰ、Ⅱ相加得 TiO2+2Cl2+2C+2Mg=Ti+2CO+2MgCl2 转移电子
48g 8mol
9.6g 1.6mol
所以每生成9.6 g Ti,反应I、II中共转移1.6 mol e-,故错误.
故选D.
点评:本题考查了概念的判断、方程式的有关计算等知识点,难度不大,注意基本概念的理解、氧化还原反应中得失电子相等等问题.

练习册系列答案
相关题目
金属钛(Ti)性能优越,被称为继铁、铝后的“第三金属”.工业上以金红石(TiO2)为原料制取Ti的反应为:
aTiO2+bCl2+cC
aTiCl4+cCO 反应(1)
TiCl4+2Mg
Ti+2MgCl2 反应(2)
关于反应(1)、(2)的分析正确的是( )
aTiO2+bCl2+cC
| ||
TiCl4+2Mg
| ||
关于反应(1)、(2)的分析正确的是( )
| A、TiCl4在反应(1)中是氧化产物,在反应(2)中是氧化剂 |
| B、C、Mg在反应中均为还原剂,被氧化 |
| C、在(1)反应方程式中,a一定等于2 |
| D、每生成9.6g Ti,反应(1)、(2)中共转移电子均为0.6mol |
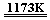 aTiCl4 + cCO
反应①
aTiCl4 + cCO
反应① Ti + 2MgCl2 反应②
Ti + 2MgCl2 反应②