题目内容
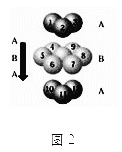
【题目】某温度下,HNO2和CH3COOH的电离常数分别为5.0×10-4和1.7×10-5。将![]() 和体积均相同的两种酸溶液分别稀释,其pH随加水体积的变化如图所示。下列叙述正确的是( )
和体积均相同的两种酸溶液分别稀释,其pH随加水体积的变化如图所示。下列叙述正确的是( )
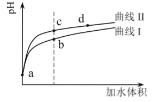
A.曲线Ⅰ代表HNO2溶液
B.溶液中水的电离程度:b点>c点
C.相同体积a点的两溶液分别与NaOH恰好中和后,溶液中n(Na+)相同
D.c点到d点,溶液中![]() 保持不变(HA、A-代表相应的酸和酸根离子)
保持不变(HA、A-代表相应的酸和酸根离子)
【答案】D
【解析】
A.HNO2和CH3COOH的电离常数分别为5.0×10-4和1.7×10-5,酸的电离平衡常数越大,酸的酸性越强,相同浓度的HNO2和CH3COOH,酸性HNO2>CH3COOH,pH相同的HNO2和CH3COOH分别加水稀释相同的倍数,pH值变化较大的是强酸,根据图知,曲线I表示CH3COOH、曲线II表示HNO2,故A错误;
B.酸抑制水电离,酸中c(H+)越大,其抑制水电离程度越大,酸中c(H+):b>c,则水的电离程度:b<c,故B错误;
C.相同体积的a点两种溶液中n(酸):n(HNO2)<n(CH3COOH),分别与NaOH恰好中和后消耗n(NaOH):HNO2<CH3COOH,所以溶液中n(Na+):HNO2<CH3COOH,故C错误;
D.温度不变水解平衡常数不变,从c点到d点温度不变,溶液中![]() =Kh(HA)不变,故D正确;
=Kh(HA)不变,故D正确;
答案选D。

 名校课堂系列答案
名校课堂系列答案【题目】X、Y、Z、W、Q、R均为前四周期元素,且原子序数依次增大。其相关信息如下表所示:
X元素的基态原子中电子分布在三个不同的能级中,且每个能级中的电子总数相同 |
Y元素的气态氢化物与其最高价氧化物对应的水化物能发生化合反应 |
Z元素的族序数是其周期数的三倍 |
W原子的第一至第六电离能分别为:I1=578KJ·mol-1I2=1817KJ·mol-1I3=2745KJ·mol-1 I4=11575KJ·mol-1I5=14830KJ·mol-1I6=18376KJ·mol-1 |
Q为前四周期中电负性最小的元素 |
元素R位于周期表的第10列 |
回答下列问题:
(1)Y元素的基态原子中未成对电子数为______;X、Y、Z三种元素原子的第一电离能由小到大的顺序为____________(用元素符号表示)。
(2)W的氯化物的熔点比Q的氯化物的熔点__________(填“高”或“低”),理由是__________________________________________________。
(3)光谱证实元素W的单质与强碱性溶液反应有[W(OH)4]-生成,则[W(OH)4]-中存在(填字母)_____________。
a.极性共价键 b.非极性共价键 c.配位键 d.氢键
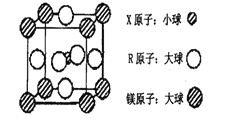
(4)含有X、R和镁三种元素的某种晶体具有超导性,其结构如下图所示。则该晶体的化学式为_______;晶体中每个镁原子周围距离最近的R原子有_______个。