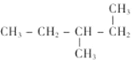
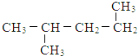��Ŀ����
����Ŀ��A��һ�ֺ�̼���⡢������Ԫ�ص��л����������ʹ��ˮ��ɫ��������ˮ�������������¿ɷ���ˮ�ⷴӦ���õ�һ����B��һ���Ӽ״���B�ķ���ʽΪC3H4O2��������û��֧��(�����һ�)����������������Һ������Ӧ��
��1��A���Է����ķ�Ӧ�� ��ѡ���ţ�
�� �ӳɷ�Ӧ �� ������Ӧ �� �Ӿ۷�Ӧ �� ������Ӧ
��2��B�������������ŵ������� �� ��
��3��A��NaOH��Һ����ʱ������Ӧ�Ļ�ѧ����ʽ�ǣ� ��
��4��д��B�����Ӿ۷�Ӧ�IJ���Ľṹ��ʽ�� ��
���𰸡���1���٢ۢ��� ��2��̼̼˫�����Ȼ�
��3��CH2��CHCOOCH3+NaOH![]() CH3OH+CH2��CHCOONa ��4��
CH3OH+CH2��CHCOONa ��4��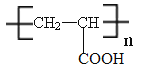
��������
���������A��һ�ֺ�̼���⡢������Ԫ�ص��л����������ʹ��ˮ��ɫ��������ˮ�������������¿ɷ���ˮ�ⷴӦ���õ�һ����B��һ���Ӽ״���B�ķ���ʽΪC3H4O2��������û��֧��(�����һ�)����������������Һ������Ӧ����˵�������к���������̼̼˫������A�Ľṹ��ʽΪCH2��CHCOOCH3��
��1��������̼̼˫�������Է����ӳɷ�Ӧ����ȷ�������ܷ���������Ӧ������������̼̼˫�������Է����Ӿ۷�Ӧ����ȷ��������̼̼˫�������Է���������Ӧ����ȷ����ѡ�٢ۢ���
��2��B�����Ľṹ��ʽΪCH2��CHCOOH�������������ŵ�������̼̼˫�����Ȼ���
��3��A��NaOH��Һ����ʱ������Ӧ�Ļ�ѧ����ʽ��CH2��CHCOOCH3+NaOH![]() CH3OH+CH2��CHCOONa��
CH3OH+CH2��CHCOONa��
��4��B�����Ӿ۷�Ӧ�IJ���Ľṹ��ʽΪ ��
��

 ���Ǽ���С����ϵ�д�
���Ǽ���С����ϵ�д� �Ͻ�ƽ���Ȿϵ�д�
�Ͻ�ƽ���Ȿϵ�д�