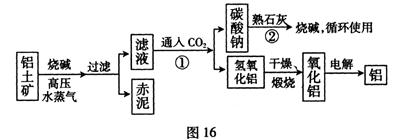
题目内容
将2.4 g镁、铝混合物粉末溶于75 mL 4 mol/L的盐酸中,反应一段时间后,再加入250mL 1.5 mol/L的NaOH溶液后待反应完全,此时溶液中大量存在的是
| A.Na+、Mg2+ | B.Al3+、Mg2+ | C.Mg2+、AlO2- | D.Na+、AlO2- |
D
HCl:n=cV= 4 mol/L×0.075L=0.3mol,NaOH:0.250L ×1.5 mol/L =0.375mol,镁铝质量为2.4g,物质的量小于0.1mol,而盐酸物质的量为0.3mol,所以盐酸过量,盐酸为0.3mol,而给出的氢氧化钠的物质的量为0.375mol,将Mg2+和Al3+沉淀后,OH―仍然过量,Mg→2H+→Mg2+ 2OH―→Mg(OH)2; Al→3H+→Al3+→3OH―→Al(OH)3,过量的碱最后变成AlO2―,故D正确。

练习册系列答案
 夺冠金卷全能练考系列答案
夺冠金卷全能练考系列答案
相关题目
 ,观察到有白色沉淀,继续加过量NaOH溶液,白色沉淀又溶解。你能得出该抗酸药中 (填含或不含)有Al(OH)3,请写出有关反应的化学方程式:
,观察到有白色沉淀,继续加过量NaOH溶液,白色沉淀又溶解。你能得出该抗酸药中 (填含或不含)有Al(OH)3,请写出有关反应的化学方程式:
 签部分表面长出白色毛状物,此白色毛状物的化学式为____, 此物质与氢氧化钠溶液反应的离子方程式为_____。
签部分表面长出白色毛状物,此白色毛状物的化学式为____, 此物质与氢氧化钠溶液反应的离子方程式为_____。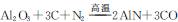 ,用该法制得的产品中常含有少量杂质。某同学拟通过下列实验装置测定产品中AIN的纯度。
,用该法制得的产品中常含有少量杂质。某同学拟通过下列实验装置测定产品中AIN的纯度。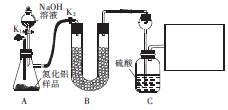
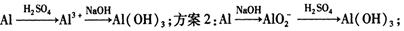
 o
o