��Ŀ����
����Ŀ����ѧ������̫���ֽܷ�ˮ���ɵ������ڴ����������������̼��Ӧ���ɼ״�����������ֱ���Լ״�Ϊȼ�ϵ�ȼ�ϵ�أ���֪H2��g����CO��g����CH3OH��l����ȼ���ȡ�H�ֱ�Ϊ��285.8kJmol��1����283.0kJmol��1�ͩ�726.5kJmol��1 �� ��ش��������⣺
��1����̫���ֽܷ�10molˮ���ĵ������� kJ��
��2���״�����ȫȼ������һ����̼��Һ̬ˮ���Ȼ�ѧ����ʽΪ ��
��3����ֱ���Լ״�Ϊȼ�ϵĵ���У�����״̬�£���ȼ�ϵ������1mol�״����ܲ�����������Ϊ702.1kJ�����ȼ�ϵ�ص�����Ч��Ϊ��ȼ�ϵ�ص�����Ч����ָ�����������������ռȼ�ϵ�ط�Ӧ�����ͷŵ�ȫ�������İٷֱȣ���
���𰸡�
��1��2858
��2��CH3OH��l��+O2��g���TCO��g��+2H2O��l����H=��443.5kJ?mol��1
��3��96.6%
���������⣺��1����H2��g����ȼ���ȡ�HΪ��285.8kJmol��1֪��1molH2��g����ȫȼ������1molH2O��l���ų�����285.8kJ�����ֽ�1mol H2O��l��Ϊ1mol H2��g�����ĵ�����Ϊ285.8kJ����ֽ�10mol H2O��l�����ĵ�����Ϊ285.8kJ��10=2858kJ�����Դ��ǣ�2858��
��2����CO��g����CH3OH��l����ȼ���ȡ�H�ֱ�Ϊ��283.0kJmol��1�ͩ�726.5kJmol��1 �� ���CO��g��+1/2O2��g��=CO2��g����H=��283.0kJmol��1��CH3OH��l��+3/2O2��g��=CO2��g��+2 H2O��l����H=��726.5kJmol��1
�ɸ�˹���ɿ�֪�âک��ٵ÷�ӦCH3OH��l��+O2��g��=CO��g��+2 H2O��l�����÷�Ӧ�ķ�Ӧ�ȡ�H=��726.5kJmol��1������283.0kJmol��1��=��443.5kJmol��1 �� ���Դ��ǣ�CH3OH��l��+O2��g��=CO��g��+2 H2O��l����H=��443.5kJmol��1��
��3��CH3OH��l����ȼ���ȡ�H�ǩ�726.5kJmol��1 �� ��֪1mol�״���Ӧ�ų�������Ϊ725.6kJ�����ȼ�ϵ�ص�����Ч��Ϊ ![]() ��100%=96.6%�����Դ��ǣ�96.6%��
��100%=96.6%�����Դ��ǣ�96.6%��

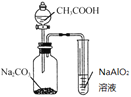
 ÿ��10���ӿ�����������������ϵ�д�
ÿ��10���ӿ�����������������ϵ�д�����Ŀ����ͼ��ʾ��ʵ�飬�ܴﵽʵ��Ŀ�ĵ���
A | B | C | D |
|
|
|
|
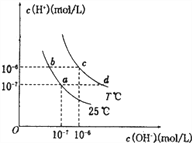
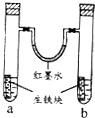
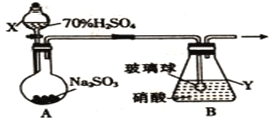
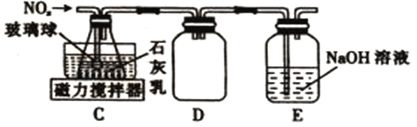
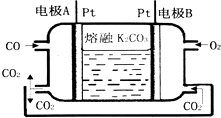
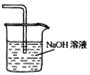
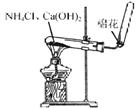
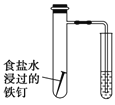
β������������NO2 | �Ʊ����� | ��֤���������ⸯʴ | ��֤���ԣ� CH3COOH>H2CO3> Al(OH)3 |
A. A B. B C. C D. D