��Ŀ����
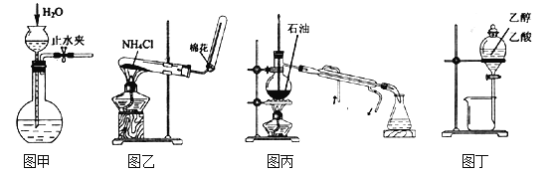
����Ŀ��ijʵ��С����0.55mol/LNaOH��Һ��0.50mol/LHCl��Һ�����к��ȵIJⶨ���ⶨ�к��ȵ�ʵ��װ����ͼ��ʾ��

(1)��ʵ��װ���Ͽ���ͼ��ȱ�ٵ�һ�ֲ�������__________��
(2)ʹ�ò�ȫ�������װ�ý���ʵ�飬ȡ50mL0.50mol/LHCl��Һ��50mL0.55mol/LNaOH��Һ��С�ձ��н����кͷ�Ӧ��ʵ�����������
ʵ����� | ��ʼ�¶�t1/�� | ��ֹ�¶� t2/�� | �¶Ȳ�ƽ��ֵ(t2-t1)/�� | ||
HCl | NaOH | ƽ��ֵ | |||
1 | 26.2 | 26.0 | 26.1 | 29.5 | ______�� |
2 | 27.0 | 27.4 | 27.2 | 33.3 | |
3 | 25.9 | 25.9 | 25.9 | 29.2 | |
4 | 26.4 | 26.2 | 26.3 | 29.8 | |
������д���еĿհף��¶Ȳ�ƽ��ֵ__________��
������ʵ����ֵ������к���57.3kJ/molƫС��������ԭ�������______��(����ĸ)
a.ʵ��װ�ñ��¡�����Ч����
b.��ȡNaOH��Һ�����ʱ���Ӷ���
c.�ֶ�ΰ�NaOH��Һ����ʢ�������С�ձ���
d.���¶ȼƲⶨNaOH��Һ��ʼ�¶Ⱥ�ֱ�ӲⶨHCl��Һ���¶�
(3)ʵ��������60mL0.25mol/LH2SO4��Һ��50mL0.55mol/LNaOH��Һ���з�Ӧ��������ʵ����ȣ����ų�������______(���ȡ���������ȡ�)�������к���______(���ȡ���������ȡ�)������50mL0.50mol/L�������HCl��Һ��������ʵ�飬��÷�Ӧǰ���¶ȵı仯ֵ��______(�ƫ����ƫС����������Ӱ�족)
���𰸡����β�������� 3.4 acd ����� ��� ƫС
��������
����к��ȵĸ�����к���ʵ�������Ҫ�㱣�£���ֹ����ɢʧ�����жϣ��к���ָǿ���ǿ���ϡ��Һ�����кͷ�Ӧ����1molˮʱ�ų����ȣ����������Լ�������Ķ����أ�����������ʵĵ���ʱ���ȹ��̡�
(1)�����ȼƵĹ����֪��װ��ȱ�ٵ�һ�������ǻ��β����������
(2)�ٵ�1���¶Ȳ�Ϊ29.5��-26.1��=3.4�棬��2���¶Ȳ�Ϊ33.3��-27.2��=6.1�棬��3���¶Ȳ�Ϊ29.2��-25.9��=3.3�棬��4���¶Ȳ�Ϊ29.8��-26.3��=3.5�棬���е�2�������������ϴ���ȥ��ʣ��3�ε�ƽ���¶�Ϊ3.4�棻
��a��װ�ñ��¡�����Ч�����õ�����ƫС���к��ȵ���ֵƫС����a���ܣ�
b����ȡNaOH��Һ�����ʱ���Ӷ������ᵼ�������������������ƫ�ų�������ƫ�ߣ��к��ȵ���ֵƫ��b�����ܣ�
c������һ�ο��ٽ�NaOH��Һ����ʢ�������С�ձ��У��������ֶ�ΰ�NaOH��Һ����ʢ�������С�ձ��У������ᵼ������ɢʧ���ⶨ��ֵƫС����c���ܣ�
d���¶ȼƲⶨNaOH��Һ��ʼ�¶Ⱥ�ֱ�Ӳ���ϡHCl���¶ȣ��������ʼ�¶�ƫ�ߣ���õ�����ƫС���к��ȵ���ֵƫС����d���ܣ�
�ʴ�Ϊ��acd��
(3)����60mL 0.25molL-1 H2SO4��Һ��50mL 0.55molL-1 NaOH��Һ���з�Ӧ��������ʵ����ȣ�����ˮ�������ȣ������ų�������Ҳ����ȣ������к���ָǿ���ǿ���ϡ��Һ��Ӧ����1molˮʱ�ų����ȣ����к�����ȣ����������ᣬ����������ȣ�������50mL0.50molL-1������������������ʵ�飬��÷�Ӧǰ���¶ȵı仯ֵ��ƫС��

 Сѧ�̲���ȫ���ϵ�д�
Сѧ�̲���ȫ���ϵ�д�����Ŀ����һ���������İ���������������Ƶ��ܱ����������(��������������䣬��������������Բ���)���ں㶨�¶���ʹ��ﵽ�ֽ�ƽ�⣺NH2COONH4(s)![]() 2NH3(g)��CO2(g)��ʵ���ò�ͬ�¶��µ�ƽ�����������±���
2NH3(g)��CO2(g)��ʵ���ò�ͬ�¶��µ�ƽ�����������±���
�¶�(��) | 15.0 | 20.0 | 25.0 | 30.0 | 35.0 |
ƽ����ѹǿ(kPa) | 5.7 | 8.3 | 12.0 | 17.1 | 24.0 |
ƽ��������Ũ��(��10-3mol/L) | 2.4 | 3.4 | 4.8 | 6.8 | 9.4 |
(1)�����жϸ÷ֽⷴӦ�Ѿ��ﵽ��ѧƽ�����____________(����ĸ���)��
A��![]() (NH3)��2
(NH3)��2![]() (CO2) B���ܱ���������ѹǿ����
(CO2) B���ܱ���������ѹǿ����
C���ܱ������л��������ܶȲ���D���ܱ����������ƽ��Ħ����������
(2)���ݱ������ݣ���ʽ����25.0��ʱ�ķֽ�ƽ�ⳣ��____________��
(3)ȡһ�����İ�������粒������һ�����������ܱ���������У���25���´ﵽ�ֽ�ƽ�⡣���ں�����ѹ�����������ƽ��ʱ������Ũ��____________(����ӡ�������С�����䡱)��
(4)��������立ֽⷴӦ���ʱ���H____________0���ر���S____________0(�>������������<��)�÷�Ӧ��____________���������������Է����С�