题目内容
【题目】某温度时,在2L的密闭容器中,X、Y、Z(均为气体)三种物质的量随时间的变化曲线如图所示。
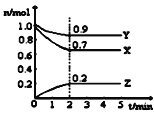
(1)由图中所给数据进行分析,该反应的化学方程式为__________。
(2)若上述反应中X、Y、Z分别为H2、N2、NH3,某温度下,在容积恒定为2.0L的密闭容器中充入2.0molN2和2.0molH2,一段时间后反应达平衡状态,实验数据如下表所示:
t/s | 0 | 50 | 150 | 250 | 350 |
n(NH3) | 0 | 0.24 | 0.36 | 0.40 | 0.40 |
0~50s内的平均反应速率 v(N2) = __________ mol·L-1·min-1,250s时,H2的转化率为____________%。
(3)已知:键能指在标准状况下,将1mol气态分子AB(g)解离为气态原子A(g),B(g)所需的能量,用符号E表示,单位为kJ/mol。![]() 的键能为946kJ/mol,H-H的键能为436kJ/mol,N-H的键能为391kJ/mol,则生成1molNH3过程中___(填“吸收”或“放出”)的能量为____ kJ, 反应达到(2)中的平衡状态时,对应的能量变化的数值为____kJ。
的键能为946kJ/mol,H-H的键能为436kJ/mol,N-H的键能为391kJ/mol,则生成1molNH3过程中___(填“吸收”或“放出”)的能量为____ kJ, 反应达到(2)中的平衡状态时,对应的能量变化的数值为____kJ。
(4)反应达平衡时容器内混合气体的平均相对分子质量比起始时____(填增大、减小或不变),混合气体密度比起始时______(填增大、减小或不变)。
(5)为加快反应速率,可以采取的措施是_______(填符号)
a.降低温度 b.增大压强 c.恒容时充入He气
d.恒压时充入He气 e.及时分离NH3 f.加入催化剂
【答案】3X+Y2Z 7.2×10-2mol/(L·min ) 30% 放出 46 kJ 18.4 增大 不变 bf
【解析】
某温度时,在2L的密闭容器中,X、Y消耗生成Z,相同时间内反应混合物中各组分的变化量之比与其化学计量数之比相同。该反应到达平衡时,X消耗0.3mol,Y消耗0.1mol,Z生成了0.2mol,故该反应的化学方程为3X+Y2Z。
(1)在2L的密闭容器中,X、Y消耗生成Z,相同时间内反应混合物中各组分的变化量之比与其化学计量数之比相同。该反应到达平衡时,X消耗0.3mol,Y消耗0.1mol,Z生成了0.2mol,故该反应的化学方程为3X+Y2Z。
(2)若上述反应为3 H2+ N22 NH3,根据平衡速率公式可知,0~50s内的平均反应速率 v(NH3) = 1.44×10-1mol/(L·min) ,v(N2) =0.5 v(NH3)= 7.2×10-2mol/(L·min );250s时,生成氨气0.4mol,消耗氢气0.6mol,H2的转化率为
1.44×10-1mol/(L·min) ,v(N2) =0.5 v(NH3)= 7.2×10-2mol/(L·min );250s时,生成氨气0.4mol,消耗氢气0.6mol,H2的转化率为![]() 。
。
(3)反应为3 H2+ N22 NH3,ΔH=反应物键能总和 - 生成物键能总和=436kJ/mol×3+946kJ/mol -391kJ/mol×3×2=-92kJ/mol,所以,产生1mol氨气放出的能量为46kJ, 反应达到(2)中的平衡状态时生成0.4mol氨气,对应的能量变化的数值为0.2×92kJ =18.4kJ。
(4)反应达平衡时容器内混合气体的质量不变,总物质的量减小,故反应混合物的平均相对分子质量比起始时增大,但是气体的总体积不变,故混合气体的密度一直不变。
(5)a.降低温度,根据有效碰撞理论,反应速率减小;
b.增大压强,单位体积内活化分子数增大,反应速率增大;
c.恒容时充入He气,不改变反应中物质的浓度,反应速率不变;
d.恒压时充入He气,容器体积增大,相当于减小压强,反应速率减小;
e.及时分离NH3,生成物物质的量下降,反应速率减小;
f.加入催化剂,降低反应的活化能,反应速率增大;
综上所述,为加快反应速率,可以采取的措施是bf。

 长江作业本同步练习册系列答案
长江作业本同步练习册系列答案