题目内容
(12分)市场出售的“热敷袋”,其主要成分是铁屑、炭粉、木屑与少量氯化钠、水等。它在使用之前需用塑料袋与空气隔绝。使用时开启塑料袋的小气孔,轻轻揉搓就会放出热量来。当使用完后还会发现有锈生成,依上述现象完成下列问题:
(1)“热敷袋”放出热量使铁发生了什么反应?
(2)炭粉的主要作用是什么?
(3)加入氯化钠的作用是什么?
(4)写出有关的电极反应与化学方程式来表明上述过程。
(1)“热敷袋”放出热量使铁发生了什么反应?
(2)炭粉的主要作用是什么?
(3)加入氯化钠的作用是什么?
(4)写出有关的电极反应与化学方程式来表明上述过程。
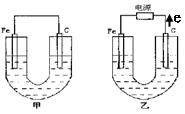
(1)铁是原电池的负极,发生了氧化反应,Fe-2e-====Fe2+
(2)炭粉是原电池的正极。
(3)食盐与水构成电解质溶液。
(4)原电池的电极反应是:
Fe负极:2Fe-4e-====2Fe2+
C正极:2H2O+O2+4e====4OH-起吸氧作用
Fe2++2OH-====Fe(OH)2↓
4Fe(OH)2+O2+2H2O====4Fe(OH)3
(2)炭粉是原电池的正极。
(3)食盐与水构成电解质溶液。
(4)原电池的电极反应是:
Fe负极:2Fe-4e-====2Fe2+
C正极:2H2O+O2+4e====4OH-起吸氧作用
Fe2++2OH-====Fe(OH)2↓
4Fe(OH)2+O2+2H2O====4Fe(OH)3
“热敷袋”利用原电池的工作原理,铁发生氧化反应放出能量。在此原电池中,Fe作负极,炭粉作正极,NaCl和水构成电解液,Fe发生吸氧腐蚀。

练习册系列答案
 一诺书业暑假作业快乐假期云南美术出版社系列答案
一诺书业暑假作业快乐假期云南美术出版社系列答案
相关题目