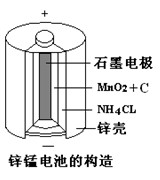
题目内容
在碱性锌锰干电池中,已知氢氧化钾为电解质,发生的电池总反应为:
Zn+2MnO2+2H2O=2MnOOH+Zn(OH)2
下列该电池的电极反应正确的是
Zn+2MnO2+2H2O=2MnOOH+Zn(OH)2
下列该电池的电极反应正确的是
| A.负极反应为Zn-2e-=Zn2+ |
| B.负极反应为Zn+2H2O-2e-= Zn(OH)2+H+ |
| C.正极反应为2MnO2+2H++ 2e-=2MnOOH |
| D.正极反应为2MnO2+2H2O + 2e-=2MnOOH+2OH- |
D
分析电池的总反应方程式,并标出变价元素的化合价
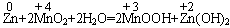 ,变价情况为
,变价情况为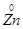

 ,
,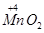

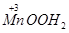 。
。
因此负极为Zn,电极反应式为Zn+2OH--2e-= Zn(OH)2;正极为MnO2,电极反应式为2MnO2+2H2O + 2e-=2MnOOH+2OH-。
在写电极反应式时要注意电解质溶液是KOH,为碱性环境。在碱性环境中不会有氢离子存在或生成,即B、C两个选项都是不合理的。
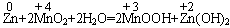 ,变价情况为
,变价情况为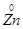

 ,
,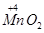

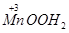 。
。因此负极为Zn,电极反应式为Zn+2OH--2e-= Zn(OH)2;正极为MnO2,电极反应式为2MnO2+2H2O + 2e-=2MnOOH+2OH-。
在写电极反应式时要注意电解质溶液是KOH,为碱性环境。在碱性环境中不会有氢离子存在或生成,即B、C两个选项都是不合理的。

练习册系列答案
相关题目