题目内容
(1)(8分)有几种元素的微粒电子层结构如图 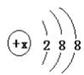 所示,其中:
所示,其中:
①某电中性微粒一般不和其他元素的原子反应,这种微粒符号是______ __。
②某微粒的盐溶液,加入AgNO3溶液时会出现白色浑浊,这种微粒的电子式是______ 。
③某微粒氧化性甚弱,但得到电子后还原性强且这种原子最外层有一个电子,这种微粒符号是__。
④某微粒具有还原性,且这种微粒失去2个电子即变为原子,这种微粒的符号是__
(2)(8分)11—18号元素中,其单质相互化合能形成 种离子化合物,最高价氧化物对应水化物酸性最强的元素是 ;最高价氧化物对应水化物碱性最强的物质的化学式为 ;气态氢化物稳定性最强的物质的电子式是________。
 所示,其中:
所示,其中: ①某电中性微粒一般不和其他元素的原子反应,这种微粒符号是______ __。
②某微粒的盐溶液,加入AgNO3溶液时会出现白色浑浊,这种微粒的电子式是______ 。
③某微粒氧化性甚弱,但得到电子后还原性强且这种原子最外层有一个电子,这种微粒符号是__。
④某微粒具有还原性,且这种微粒失去2个电子即变为原子,这种微粒的符号是__
(2)(8分)11—18号元素中,其单质相互化合能形成 种离子化合物,最高价氧化物对应水化物酸性最强的元素是 ;最高价氧化物对应水化物碱性最强的物质的化学式为 ;气态氢化物稳定性最强的物质的电子式是________。
(1)①Ar (2分) ②(略) (2分)③ K+(2分) ④S2-(2分)
(2) 4 ; CI(或氯);NaOH(写名称不得分) (HCl电子式略)
(2) 4 ; CI(或氯);NaOH(写名称不得分) (HCl电子式略)
(1)①呈电中性,则x=2+8+8=18,故为Ar;
..
②白色沉淀为氯化银,故电子式为:[:Cl:]-;
..
③这种原子的核外电子排布为:2 8 8 1,该离子为K+,其核外电子排布为:2 8 8;
④S2-的核外电子排布为:2 8 8,失去2个电子后变为硫原子,其其核外电子排布为:2 8 6;
(2)单质相互化合能形成NaCl、Na2S、MgCl2、MgS,共4种离子化合物;
同周期,越往右,最高价氧化物对应水化物酸性越强,越往左,最高价氧化物对应水化物碱性越强(惰性气体元素不考虑);
同周期,由左到右,原子的得电子能力逐渐增强,则气态氢化物的稳定性增强,所以气态氢
..
化物稳定性最强的物质是HCl,其电子式为 H:Cl:
..
②白色沉淀为氯化银,故电子式为:[:Cl:]-;
..
③这种原子的核外电子排布为:2 8 8 1,该离子为K+,其核外电子排布为:2 8 8;
④S2-的核外电子排布为:2 8 8,失去2个电子后变为硫原子,其其核外电子排布为:2 8 6;
(2)单质相互化合能形成NaCl、Na2S、MgCl2、MgS,共4种离子化合物;
同周期,越往右,最高价氧化物对应水化物酸性越强,越往左,最高价氧化物对应水化物碱性越强(惰性气体元素不考虑);
同周期,由左到右,原子的得电子能力逐渐增强,则气态氢化物的稳定性增强,所以气态氢
..
化物稳定性最强的物质是HCl,其电子式为 H:Cl:

练习册系列答案
 仁爱英语同步练习册系列答案
仁爱英语同步练习册系列答案 学习实践园地系列答案
学习实践园地系列答案
相关题目


 mol
mol mol
mol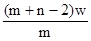 mol
mol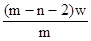 mol
mol