题目内容
海水是巨大的资源宝库,从海水中提取食盐和溴的过程如下:

(1)从海水中可以得到食盐。为了除去粗盐中的Ca2+、Mg2+、SO2-4及泥沙,可将粗盐溶于水,然后进行下列五项操作:①过滤,②加过量NaOH溶液,③加适量盐酸,④加过量NaCO3溶液,⑤加过量BaCl2溶液。正确的操作顺序是 。
?A.①④②⑤③ B.④①②⑤③ C.②⑤④①③ D.②④⑤①③
?(2)电解 NaCl溶液是氯碱工业的核心反应,请写出其化学方程式
。
??(3)步骤Ⅰ中已获得Br2,步骤Ⅱ中又将Br2还原为Br-,其目的为 。
? (4)步骤Ⅱ用SO2水溶液吸收Br2,吸收率可达95%,有关反应的离子方程式为
,由此反应可知,除环境保护外,在工业生产中应解决的主要问题是 。
? (5)某化学研究性学习小组为了解从工业溴中提纯溴的方法,查阅了有关资料,Br2的沸点为59℃。微溶于水,有毒性和强腐蚀性。他们参观生产过程后,绘制了如右装置简图,请你参与分析讨论:
?
①整套实验装置中仪器连接均不能用橡胶塞和橡胶管,其原因是
。
? ②实验装置气密性良好,要达到提纯溴的目的,操作中如何控制关键条件:
。
? ③C中液体产生颜色为 。为除去该产物中仍残留的少量Cl2,可向其中加入NaBr溶液,充分反应后,再进行的分离操作是 。
(1)C(1分)
?(2)2NaCl+2H2O====== 2NaOH+H2↑+Cl2↑(2分)
?(3)富集溴元素(1分)
?(4)Br2+SO2+2H2O=4H++2Br-+SO2-4(2分)强酸对设备的严重腐蚀(1分)
?(5)①Br2腐蚀橡胶(1分)②控制温度计b的温度,并收集59℃时的馏分(1分)③深红棕色(1分) 分液(或蒸馏)(1分)
解析:
略

 出彩同步大试卷系列答案
出彩同步大试卷系列答案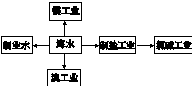
| A、海水制淡水主要有蒸馏法、电渗析法、离子交换法等 | B、海水制盐、发展氯碱工业都是发生物理变化 | C、海水提溴过程中先通入Cl2将溴离子氧化为溴单质 | D、工业上用电解熔融MgCl2的方法制取金属镁 |




