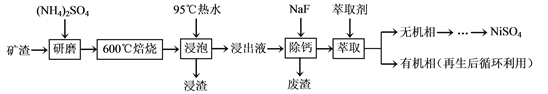
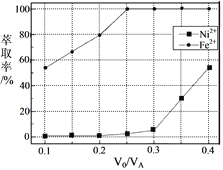
题目内容
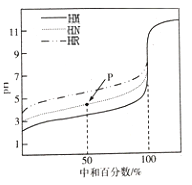
【题目】常温时,用0.1000mol/ LNaOH溶液滴定25.00mL0.1000mol/L某一元酸HX溶液,滴定过程中pH变化曲线如图所示。下列说法正确的是
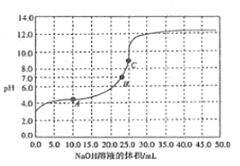
A. HX为强酸
B. 在A点,c(HX)>c(X-)>c(Na+)>c(H+)>c(OH-)
C. 在B点,两者恰好完全反应
D. 在C点.c(X-)+ c(HX)=0.1mol/L
【答案】B
【解析】A.根据图像,0.1000mol/L某一元酸HX,其2<pH<4,为弱酸,故A错误;B.在A点,显酸性,碱不足,则溶液中的溶质为HX和NaX,结合量的关系可知c(HX)>c(X-)>c(Na+)>c(H+)>c(OH-),故B正确;C.在B点,pH=7,加入的NaOH溶液的体积小于25.00mL,溶质为HX和NaX,显然碱不足,没有恰好完全反应,故C错误;D.C点,溶液的总体积为50.00mL,由物料守恒可知c(X-)+c(HX)= ![]() =0.05mol/L,故D错误;故选B。
=0.05mol/L,故D错误;故选B。

练习册系列答案
 小学学习好帮手系列答案
小学学习好帮手系列答案 小学同步三练核心密卷系列答案
小学同步三练核心密卷系列答案
相关题目
【题目】为完成相应实验,实验器材(规格和数量不限)足够的一项是
相应实验 | 实验器材(省略夹持装置) | |
A | 氯化钠溶液的浓缩结晶 | 烧杯、玻璃棒、酒精灯 |
B | 用盐酸除去硫酸钡中的少量碳酸钡 | 烧杯、漏斗、胶头滴管、滤纸 |
C | 用浓硫酸配制0.5mol·L-1的溶液 | 烧杯、玻璃棒、胶头滴管、容量瓶 |
D | 用溴水和CCl4除去NaBr溶液中的少量NaI | 烧杯、玻璃棒、胶头滴管、分液漏斗 |
A. A B. B C. C D. D