题目内容
(2011?台州模拟)下列叙述正确的是( )
分析:A、利用单位的不同,根据热值来计算反应热;
B、利用离子能否发生反应来分析离子的共存问题;
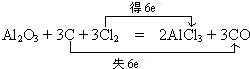
C、利用氧化还原反应来分析发生的反应,并利用电子守恒及电荷守恒来分析离子方程式;
D、根据离子积和溶度积来分析是否有沉淀生成.
B、利用离子能否发生反应来分析离子的共存问题;
C、利用氧化还原反应来分析发生的反应,并利用电子守恒及电荷守恒来分析离子方程式;
D、根据离子积和溶度积来分析是否有沉淀生成.
解答:解:A、H2热值为142.9kJ?g-1,则氢气的燃烧热为142.9×2kJ/mol=285.8kJ?mol-1,则燃烧的热化学方程式可表示为H2(g)+
O2(g)=H2O(l)△H=-285.8kJ?mol-1,故A错误;
B、因Al3+、Cu2+与F-发生相互促进的水解而生成弱电解质,则该组离子不能大量共存,故B错误;
C、因亚铁离子具有还原性,能被空气中的氧气氧化,则发生反应4Fe2++O2+4H+=4Fe3++2H2O,遵循电子守恒和电荷守恒,故C正确;
D、因c(Ag+)2×c(SO42-)=(0.01)2×0.01<KSP(Ag2SO4)=1.4×10-5,则不会有沉淀生成,故D错误;
故选C.
| 1 |
| 2 |
B、因Al3+、Cu2+与F-发生相互促进的水解而生成弱电解质,则该组离子不能大量共存,故B错误;
C、因亚铁离子具有还原性,能被空气中的氧气氧化,则发生反应4Fe2++O2+4H+=4Fe3++2H2O,遵循电子守恒和电荷守恒,故C正确;
D、因c(Ag+)2×c(SO42-)=(0.01)2×0.01<KSP(Ag2SO4)=1.4×10-5,则不会有沉淀生成,故D错误;
故选C.
点评:本题综合性较强,,考查了多个知识点,符合高考中的冷拼题,学生应注意及时转化思维来解答此类习题.

练习册系列答案
 名校课堂系列答案
名校课堂系列答案
相关题目
 (2011?台州模拟)下列关于有机化合物1和2的说法中正确的是( )
(2011?台州模拟)下列关于有机化合物1和2的说法中正确的是( )