题目内容
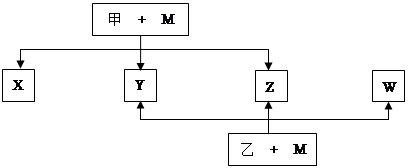
下图是无机物A~M在一定条件下的转化关系(部分产物及反应条件未列出)。其中,I是地壳中含量最高的金属,K是一种红棕色气体。 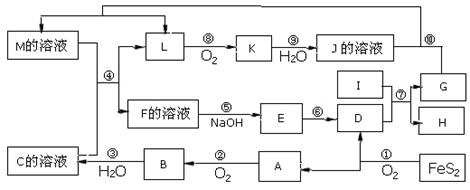
请填写下列空白:
(1)组成单质I的元素在周期表中的位置为 。
(2)欲检验F溶液中是否含有少量M,可选择的试剂为 (填化学式)。
(3)在反应⑦中还原剂与氧化剂的物质的量之比为___________________。
(4)某同学取F的溶液,酸化后加入KI、淀粉溶液,变为蓝色。写出与上述变化过程相关的离子方程式: 。
(5)将化合物D 与KNO3、KOH 共融,可制得一种“绿色”环保高效净水剂K2FeO4(高铁酸钾).同时还生成KNO2和H2O 。该反应的化学方程式是__________________________。
(6)镁与I的合金是一种潜在的贮氢材料,可在氩气保护下,将一定化学计量比的Mg、I单质在一定温度下熔炼获得。
①熔炼制备镁I合金时通入氩气的目的是 。
②I电池性能优越,I-Ag2O 电池可用作水下动力电源,其原理如图所示。该电池反应的化学方程式为 。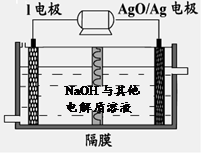
(1)第三周期IIIA族
(2)酸性KMnO4溶液(其他合理答案也可给分)。
(3)2 :1
(4)2Fe3++2I- 2Fe2++I2
2Fe2++I2
(5)Fe2O3+3KNO3+4KOH 2K2FeO4+3KNO2+2H2O
2K2FeO4+3KNO2+2H2O
(6)①防止Mg、Al 被空气氧化
②2Al+3Ag2O+2NaOH=2NaAlO2+6Ag+H2O
解析试题分析:本题的突破口为I是地壳中含量最高的金属,可知I为Al元素;K是一种红棕色气体,结合化学反应可知K为NO2,然后带入框图进行推断,得出其它物质,A为SO2,B为SO3,C为H2SO4,D为Fe2O3,E为Fe(OH)3,I为Al,G为Al2O3,H为Fe,L为NO,K为NO2,J为HNO3,M为Fe(NO3)2,F为Fe(NO3)3 。
(1)I为Al元素,在元素周期表中的位置:第三周期IIIA族。
(2)用酸性KMnO4溶液可检验Fe(NO3)3中的Fe(NO3)2,。
(3)反应⑦为Al与Fe2O3发生的铝热反应:2Al+Fe2O3 2Fe+Al2O3,还原剂为Al,Fe2O3为氧化剂,所以还原剂与氧化剂的物质的量之比为2:1。
2Fe+Al2O3,还原剂为Al,Fe2O3为氧化剂,所以还原剂与氧化剂的物质的量之比为2:1。
(4)Fe3+把I?氧化为I2,配平可得离子方程式:2Fe3++2I- 2Fe2++I2
2Fe2++I2
(5)化合物为Fe2O3,根据题意写出反应物和生成物,由化合价升降法配平可得化学方程式。
(6)①Mg、Al为活泼金属,容易被空气中的氧气氧化,所以通入氩气可防止Mg、Al 被空气氧化。
②根据示意图可知Al为负极、Ag2O为正极,NaOH为电解质溶液,电池的总反应方程式为:2Al+3Ag2O+2NaOH=2NaAlO2+6Ag+H2O。
考点:本题考查物质的推断、化学方程式和离子方程式的书写、元素周期表、物质的检验、氧化剂和还原剂的判断。

为除去括号内的杂质,所选用的试剂或方法不正确的是
| A.NaHCO3溶液(Na2CO3溶液) 通入过量的CO2 |
| B.铁粉(铝粉) 加入适量的NaOH溶液过滤 |
| C.Na2CO3溶液(Na2SO4溶液) 加入适量的Ba(OH)2溶液过滤 |
| D.CO2 (CO) 将混合气体通过足量灼热的CuO |

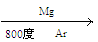 Ti
Ti