题目内容
【题目】某课外活动小组欲利用CuO与NH3的反应研究NH3的性质与分子组成,设计了如下实验装置(夹持装置未画出)进行实验。请回答下列问题:
(1)仪器a的名称为 ;仪器b中的试剂不能为下列中的 (填字母)
A.氧化钙 B.碱石灰 C.石灰石 D.生石灰
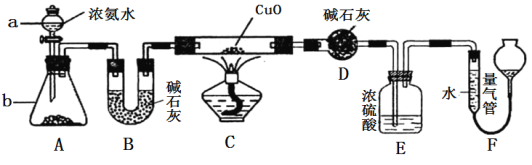
(2)装置B的作用是
(3)实验中观察到装置C中黑色CuO粉末变为红色固体,量气管收集到无色无味的气体,上述现象证明了NH3具有 性,写出装置C中发生反应的化学方程式
(4)E装置中浓硫酸的作用 (写出一条即可)
(5)实验完毕,若测得干燥管D增重mg,装置F测得气体的体积为nL(已折算成标准状况),则氨分子中氮、氢的原子个数比为 (用含m、n字母的代数式表示)
【答案】(1)分液漏斗,C;(2)干燥氨气;
(3)还原,3CuO+2NH3![]() 3Cu+N2↑+3H2O;
3Cu+N2↑+3H2O;
(4)阻止F中水蒸气进入D(或吸收未反应的氨气);(5)9n/11.2m。
【解析】
试题分析:(1)仪器a的名称为分液漏斗,装置A作用制取NH3,利用NH3·H2O不稳定,受热易分解,氧化钙、碱石灰、生石灰遇水放出大量的热,使NH3·H2O分解,因此选项C正确;(2)装置B的作用是干燥NH3,防止水蒸气对后面实验产生干扰;(3)CuO变为红色铜,铜的化合价降低,且量气管中收集到无色无味的气体,此气体为N2,因此NH3表现还原性,反应方程式为:3CuO + 2NH3![]() 3Cu + N2↑ + 3H2O;(4)装置D的作用是吸收反应中产生的水,同时部分NH3未参加反应,必须吸收,因此装置E的作用是吸收未反应的氨气和防止F中的水蒸气进入D装置;(5)装置D增重的是水的质量,则m(H)=m×2/18g,F中测量的氮气的体积,即n(N)=n×2/22.4mol,则N和H的原子个数比为:n×2/22.4:m×2/18=9n/11.2m。
3Cu + N2↑ + 3H2O;(4)装置D的作用是吸收反应中产生的水,同时部分NH3未参加反应,必须吸收,因此装置E的作用是吸收未反应的氨气和防止F中的水蒸气进入D装置;(5)装置D增重的是水的质量,则m(H)=m×2/18g,F中测量的氮气的体积,即n(N)=n×2/22.4mol,则N和H的原子个数比为:n×2/22.4:m×2/18=9n/11.2m。

 导学全程练创优训练系列答案
导学全程练创优训练系列答案