题目内容
【题目】实验室常用MnO2与浓盐酸反应来制备氯气:MnO2+4HCl=MnCl2+2H2O+Cl2↑,在此反应中:
(1)氧化产物是;
(2)氧化剂与还原剂的物质的量之比为;
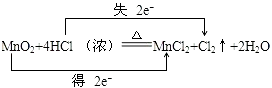
(3)用双线桥法标出电子转移的方向和数目:;
(4)若要产生112mL氯气,则转移的电子数目是;
(5)将此反应改写成离子方程式
【答案】
(1)Cl2
(2)1:2
(3)
(4)0.01NA
(5)MnO2+4H++Cl﹣=Mn2++2H2O+Cl2↑
【解析】解:反应MnO2+4HCl═MnCl2+Cl2+2H2O中,Mn元素化合价降低,被还原,MnO2为氧化剂,Cl元素化合价升高,被氧化,HCl为还原剂,Cl2为氧化产物,MnCl2为还原产物,氧化剂与还原剂的物质的量之比为 1:2,氧化剂和还原剂得失电子数目相等,由元素化合价的变化可知转移的电子数目为2,用“双线桥法”表示氧化还原反应中电子转移情况为: 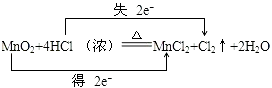 ,所以答案是:(1)Cl2;(2)1:2 (3)
,所以答案是:(1)Cl2;(2)1:2 (3)  ;(4)根据HCl中Cl元素化合价升高生成Cl2 , 所以若要产生112mL氯气,则转移的电子数目是
;(4)根据HCl中Cl元素化合价升高生成Cl2 , 所以若要产生112mL氯气,则转移的电子数目是 ![]() ×2=0.01NA , 所以答案是:0.01NA;(5)反应MnO2+4HCl═MnCl2+Cl2+2H2O中,改写成离子方程式为MnO2+4H++Cl﹣=Mn2++2H2O+Cl2↑,所以答案是:MnO2+4H++Cl﹣=Mn2++2H2O+Cl2↑.
×2=0.01NA , 所以答案是:0.01NA;(5)反应MnO2+4HCl═MnCl2+Cl2+2H2O中,改写成离子方程式为MnO2+4H++Cl﹣=Mn2++2H2O+Cl2↑,所以答案是:MnO2+4H++Cl﹣=Mn2++2H2O+Cl2↑.

练习册系列答案
 字词句篇与同步作文达标系列答案
字词句篇与同步作文达标系列答案 走进文言文系列答案
走进文言文系列答案
相关题目