题目内容
14.下列离子方程式的书写不正确的是( )| A. | 碳酸氢钙与过量氢氧化钠溶液:Ca2++2HCO3-+2OH-═CaCO3↓+2H2O+CO32- | |
| B. | 硫化钠溶于水呈碱性:S2-+2H2O?H2S+2OH- | |
| C. | 用石墨棒作为电极材料电解饱和食盐水:2Cl-+2H2O$\frac{\underline{\;电解\;}}{\;}$Cl2↑+H2↑+2OH- | |
| D. | 明矾溶液与小苏打溶液混合:Al3++3HCO3-=Al(OH)3↓+3CO2↑ |
分析 A.强氧化钠过量,反应生成碳酸钙沉淀、碳酸钠和水;
B.硫化钠中硫离子水解分步进行,主要以第一步为主;
C.用石墨棒作为电极材料电解饱和食盐水,反反应生成氯气、氢气和强氧化钠;
D.铝离子和碳酸氢根离子发生双水解反应生成氢氧化铝沉淀和二氧化碳气体.
解答 解:A.碳酸氢钙与过量氢氧化钠溶液,反应生成碳酸钙、碳酸钠和水,反应的离子方程式为:Ca2++2HCO3-+2OH-═CaCO3↓+2H2O+CO32-,故A正确;
B.硫离子有两步水解,以第一步水解为主,正确的水解离子方程式为:S2-+H2O?HS-+OH-,故B错误;
C.用石墨棒作为电极材料电解饱和食盐水,反应的离子方程式为:2Cl-+2H2O$\frac{\underline{\;电解\;}}{\;}$Cl2↑+H2↑+2OH-,故C正确;
D.明矾溶液中的铝离子与小苏打溶液中的碳酸氢根离子发生双水解反应,反应的离子方程式为:Al3++3HCO3-=Al(OH)3↓+3CO2↑,故D正确;
故选B.
点评 本题考查了离子方程式的书写判断,为高考的高频题,属于中等难度的试题,注意掌握离子方程式的书写原则,明确离子方程式正误判断常用方法,如:检查反应物、生成物是否正确,检查各物质拆分是否正确,如难溶物、弱电解质等需要保留化学式,检查是否符合原化学方程式等.

练习册系列答案
相关题目
5.在恒温体积可变的密闭容器中发生如下反应:A(g)+B(g)?2C(g)△H<0.t1时刻达到平衡后,在t2时刻改变某一条件达新平衡,其反应过程如图.下列说法中错误的是( )


| A. | 新旧平衡态时,A的体积分数相同 | |
| B. | 由旧平衡变为新平衡态,平衡常数不变 | |
| C. | 旧平衡态的v正与新平衡态的v逆相等 | |
| D. | t2时刻速率突变的原因是向密闭容器中加C或B |
2.下列关于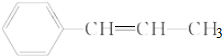 的说法正确的是( )
的说法正确的是( )
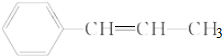 的说法正确的是( )
的说法正确的是( )| A. | 所有碳原子都可能在同一平面上 | |
| B. | 最多只可能有6个碳原子在同一平面上 | |
| C. | 有5个原子可能在同一直线上 | |
| D. | 所有原子可能在同一平面上 |
9.下列装置或操作能达到实验目的是( )
| A. | 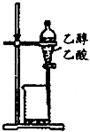 除去乙醇中的乙酸 | B. | 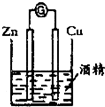 形成原电池 | ||
| C. |  制取乙酸乙酯 制取乙酸乙酯 | D. | 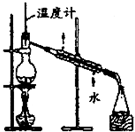 石油的分馏 |
19.下列描述正确的是( )
| A. | “冰,水为之,而寒于水”说明相同质量的水和冰,冰的能量高 | |
| B. | 水加热到很高的温度都难以分解,主要原因是水分子间可以形成氢键的缘故 | |
| C. | 增大反应物浓度,可增大单位体积内活化分子数,使单位时间内有效碰撞次数增加 | |
| D. | 同时改变两个变量来研究反应速率的变化,能更快得出有关规律 |
6.宋代著名法医学家宋慈的《洗冤集录》中有“银针验毒”的记录,“银针验毒”的原理是4Ag+2H2S+O2═2Ag2S+2H2O下列有关该反应的说法正确的是( )
| A. | Ag是氧化物 | B. | O2被氧化 | ||
| C. | H2S发生还原反应 | D. | H2S未发生电子转移 |
3.新装住房里的装饰材料(如胶合板)会释放出一种刺激性气味的气体,它是居室空气污染的主要来源.该气体是( )
| A. | CH3Cl | B. | NH3 | C. | HCHO | D. | SO2 |
4.下列化学用语表达不正确的是( )
| A. | 一氯乙烷的结构式CH3CH2Cl | B. | 丙烷分子的球棍模型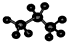 | ||
| C. | 丁烷的结构简式CH3(CH2)2CH3 | D. | 苯的分子式C6H6 |