题目内容
【题目】亚氯酸钠(NaClO2)是一种高效氧化剂和优质漂白剂。一种以氯酸钠(NaClO3)为原料制备NaClO2粗品的工艺流程如下图所示:
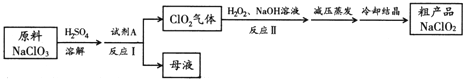
已知:
①纯ClO2易分解爆炸,空气中ClO2的体积分数在10%以下比较安全;
②NaClO2在碱性溶液中稳定存在,在酸性溶液中迅速分解;
③含水NaClO2受热易分解。
(1) 试剂A可以选择___________(填字母序号)。
a. SO2 b. 浓硝酸 c. KMnO4
(2) 下列关于上述流程的说法中,合理的是________(填字母序号)。
a. 反应Ⅰ进行过程中应持续鼓入空气
b. 反应Ⅰ后得到的母液中,溶质的主要成分是NaCl
c. 反应Ⅱ中NaOH 应过量
(3) 反应Ⅱ的离子方程式为 。
(4) 已知压强越大,物质的沸点越高。反应Ⅱ结束后采用“减压蒸发”操作的原因是_________________。
(5) NaClO2变质可分解为NaClO3和NaCl。取等质量变质前后的NaClO2试样均配成溶液,分别与足量FeSO4溶液反应时,消耗Fe2+的物质的量 。(填“相同”,“不同”或“无法判断”)
(6) 中间产物二氧化氯(ClO2)在生产生活中也有广泛应用。用ClO2处理泄漏的氰化钠(NaCN),得到无毒的NaCl、N2 和CO2。若处理含NaCN 4×10-5mol ·L-1的废水 1000L,至少需要ClO2 的质量为___________g。
(7) ClO2是一种高效水处理剂,可用亚氯酸钠和稀盐酸为原料制备。写出该制备反应的化学方程式 。
【答案】(1)a(2分) (2)ac(2分)
(3)2ClO2 + H2O2 + 2OH- === 2ClO2- + 2H2O + O2(2分)
(4)在较低温度蒸发浓缩,可防止温度过高NaClO2分解(2分)
(5)相同(2分)(6)2.7(2分)
(7)5NaClO2+4HCl=5NaCl+4ClO2↑+2H2O(2分)
【解析】
试题分析:(1)结合流程图可知,反应Ι为ClO3-到ClO2,氯元素化合价降低,需加入还原剂A发生氧化还原反应,b、c均为氧化剂,所以试剂A选择a;
(2)反应Ⅰ进行过程中需不断鼓入空气,使二氧化氯的含量保持低浓度,且反应I后的母液中含有硫酸钠,因为二氧化氯在碱性条件下稳定存在,所以加入NaOH应过量,答案选ac。
(3)由流程图最后的产品为NaClO2可知,该过程中氯元素被还原,所以反应II的离子方程式为:2ClO2 + H2O2 + 2OH- === 2ClO2- + 2H2O + O2;
(4)因为压强越大,物质的沸点越高,所以反应Ⅱ结束后采用“减压蒸发”操作的原因是在较低温度蒸发浓缩,可防止温度过高NaClO2分解。
(5)NaClO2变质可分解为NaClO3和NaCl,Cl元素从+3价变为+5价和-1价,反应为3NaClO2=2NaClO3+ NaCl,NaClO2试样与足量FeSO4溶液反应3ClO2- + 12Fe2+ + 6H2O = 4Fe(OH)3↓ + 3Cl- + 8Fe3+,最终得到Cl元素由+3价变为-1价,所以NaClO2变质前后分别与Fe2+反应时,最终均得到等量NaCl,Cl元素均由+3价变为-1价,根据电子守恒,两个过程中得到的电子的物质的量相同
(6)由题给条件反应的方程式为:2ClO2 + 2NaCN = 2NaCl + N2 + 2CO2 ,n(NaCN) = 4 × 10-5 × 1000 = 0.04 mol,由化学方程式可知n(ClO2) = 0.04mol ,m(ClO2) = 0.04 × 67.5 = 2.7g。
(7)ClO2是一种高效水处理剂,可用亚氯酸钠和稀盐酸为原料制备。则该反应的化学方程式为5NaClO2+4HCl=5NaCl+4ClO2↑+2H2O。

 作业辅导系列答案
作业辅导系列答案【题目】在Na+浓度为0.5molL﹣1的某澄清溶液中,还可能含有下表中的若干种离子.
(已知H2SiO3为不溶于水的胶状沉淀,加热时易分解为两种氧化物)
阳离子 | K+ | Ag+ | Ca2+ | Ba2+ |
阴离子 | NO3﹣ | CO32﹣ | SiO32﹣ | SO42﹣ |
现取该溶液100mL进行如下实验(气体体积均在标准状况下测定).
序号K] | 实验内容 | 实验结果 |
Ⅰ | 向该溶液中加入足量稀盐酸 | 产生白色胶状沉淀并放出标准状况下0.56L气体 |
Ⅱ | 将Ⅰ的反应混合液过滤,对沉淀洗涤、灼烧至恒重,称量所得固体质量 | 固体质量为2.4g |
Ⅲ | 向Ⅱ的滤液中滴加BaCl2溶液 | 无明显现象 |
请回答下列问题.
(1)实验Ⅰ能确定一定不存在的离子是;
(2)实验Ⅰ中生成气体的离子方程式为;
(3)通过实验Ⅰ、Ⅱ、Ⅲ和必要计算,填写下表中阴离子的浓度(能计算出的,填写计算结果,一定不存在的离子填“0”,不能确定是否存在的离子填“?”).
阴离子 | NO3﹣ | CO32﹣ | SiO32﹣ | SO42﹣ |
c/molL﹣1 |