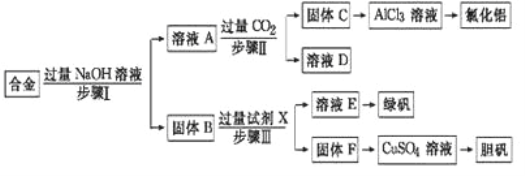
题目内容
【题目】连二次硝酸(H2N2O2)是一种二元酸,可用于制N2O气体.
(1)连二次硝酸中氮元素的化合价为 .
(2)常温下,用0.01molL﹣1的NaOH溶液滴定10mL001molL﹣1H2N2O2溶液,测得溶液PH与NaOH溶液体积的关系如图所示. 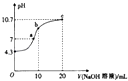
①写出H2N2O2在水溶液中的电离方程式: .
②c点时溶液中各离子浓度由大到小的顺序为 .
③b点时溶液中c(H2N2O2)(填“>”“<”或“=”,下同)c(N2O22﹣).
④a点时溶液中c(Na+)c(HN2O2﹣)+c(N2O22﹣).
(3)硝酸银溶液和连二次硝酸钠溶液混合,可以得到黄色的连二次硝酸银沉淀,向该分散系中滴加硫酸钠溶液,当白色沉淀和黄色沉淀共存时,分散系中 ![]() = [已知Ksp(Ag2N2O2)=4.2×10﹣9 , Ksp(Ag2SO4)=1.4×10﹣5].
= [已知Ksp(Ag2N2O2)=4.2×10﹣9 , Ksp(Ag2SO4)=1.4×10﹣5].
【答案】
(1)+1
(2)H2N2O2?HN2O2﹣+H+;c(Na+)>c(N2O22﹣)>c(OH﹣)>c(HN2O2﹣)>c(H+);>;>
(3)3.0×10﹣4
【解析】解:(1)H2N2O2分子中H的化合价为+1,O元素的化合价为﹣2,设N元素的化合价为x,根据总化合价之和为0可知:2x+(+1)×2+(﹣2)×2=0,解得:x=1,即N元素的化合价为+1, 所以答案是:+1;(2)①根据图象可知,氢氧化钠溶液体积为0时,0.01mol/L的H2N2O2溶液的pH=4.3,说明H2N2O2为二元弱酸,二元弱酸只要以第一步电离为主,则其电离方程式为:H2N2O2HN2O2﹣+H+ ,
所以答案是:H2N2O2HN2O2﹣+H+;②c点滴入20mL相同浓度的NaOH溶液,反应后溶质为Na2N2O2 , HN2O2﹣部分水解,溶液呈碱性,则:c(OH﹣)>c(H+),由于溶液中氢氧根离子还来自水的电离及HN2O2﹣的水解,则c(OH﹣)>c(HN2O2﹣),溶液中离子浓度大小为:c(Na+)>c(N2O22﹣)>c(OH﹣)>c(HN2O2﹣)>c(H+),
所以答案是:c(Na+)>c(N2O22﹣)>c(OH﹣)>c(HN2O2﹣)>c(H+);③c点溶质为NaHN2O2 , 溶液的pH>7,说明溶液显示碱性,则HN202﹣的水解程度大于其电离程度,所以c(H2N2O2)>c(N2O22﹣),
所以答案是:>;④根据图象可知,a点时溶液的pH=7,溶液呈中性,则c(OH﹣)=c(H+),根据电荷守恒可知c(Na+)=c(HN2O2﹣)+2c(N2O22﹣),所以c(Na+)>c(HN2O2﹣)+c(N2O22﹣),
所以答案是:>;(3)当两种沉淀共存时, ![]() =
= ![]() =
= ![]() =3.0×10﹣4 ,
=3.0×10﹣4 ,
所以答案是:3.0×10﹣4 .

 阅读快车系列答案
阅读快车系列答案