题目内容
【题目】(1)下列五个反应
A.5Cl2+I2+6H2O=10HCl+2HIO3
B.2Cl2+2Ca(OH)2=CaCl2+Ca(ClO)2+2H2O
C.2KMnO4+16HCl=2MnCl2+2KCl+5Cl2↑+8H2O
D.2NaCl+2H2O![]() 2NaOH+Cl2↑+H2↑
2NaOH+Cl2↑+H2↑
E.MnO2+4HCl![]() MnCl2+Cl2↑+2H2O
MnCl2+Cl2↑+2H2O
上述反应中氯元素只被氧化的是_____________,(填字母,下同)只被还原的是_____________,部分被氧化的是_____________,C中被氧化与被还原的物质的量之比为_____________。
(2)在反应4(NH4)2SO4![]() N2↑+6NH3↑+3SO2↑+SO3↑+7H2O中,氧化产物与还原产物的物质的量之比为___________,生成56gN2转移的电子___________mol。
N2↑+6NH3↑+3SO2↑+SO3↑+7H2O中,氧化产物与还原产物的物质的量之比为___________,生成56gN2转移的电子___________mol。
(3)饮用水中的NO3-对人类健康会产生危害,为了降低饮用水中NO3-的浓度,某饮用水研究人员提出,在碱性条件下用铝粉将NO3-还原为N2,其化学方程式为:10A1+6NaNO3+4NaOH==10NaA1O2+3N2↑+2H2O。上述反应中,若产生2mol N2,转移电子数为_________(用NA表示阿伏加德罗常数);用“双线桥”表示反应中电子转移,化合价的变化,反应类型:______________。
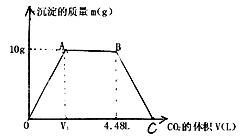
(4)将等质量的两份镁、铝合金分别投入足量的NaOH和HCl中,在相同的情况下测得生成气体的体积之比为1:2,求合金中镁、铝的物质的量之比为___________。
【答案】 D A B、C、E 5:1 1:3 12 20NA  3:2
3:2
【解析】(1)反应A中氯元素化合价降低,被还原;反应B中氯气既是氧化剂,也是还原剂;反应C中氯元素化合价部分升高,被氧化;反应D中氯元素化合价升高,被氧化;反应E中氯元素化合价升高,被氧化;则上述反应中氯元素只被氧化的是D,只被还原的是A,部分被氧化的是B、C、E;根据方程式可知C中被氧化与被还原的物质的量之比为10:2=5:1;(2)在反应4(NH4)2SO4=N2↑+6NH3↑+3SO2↑+SO3↑+7H2O中氮元素化合价从-3价升高到0价,失去3个电子,氮气是氧化产物,硫元素化合价从+6价降低到+4价,得到2个电子,二氧化硫是还原产物,氧化产物与还原产物的物质的量之比为1:3,56gN2的物质的量是2mol,因此转移的电子的物质的量是2mol×6=12mol。(3)反应中氮元素化合价从+5价降低到0价,得到5个电子,因此若产生2mol N2,转移电子的物质的量是2mol×5×2=20mol,电子数为20NA;铝元素化合价从0价升高到+3价,失去3个电子,根据电子得失守恒可知电子转移的方向和数目可表示为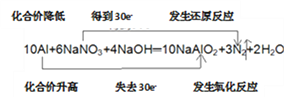 。(4)设镁的物质的量是xmol,铝的物质的量是ymol。镁只能与盐酸反应产生氢气,则生成的氢气是xmol。铝与盐酸或氢氧化钠反应生成的氢气均是1.5ymol,则
。(4)设镁的物质的量是xmol,铝的物质的量是ymol。镁只能与盐酸反应产生氢气,则生成的氢气是xmol。铝与盐酸或氢氧化钠反应生成的氢气均是1.5ymol,则![]() ,解得x:y=3:2。
,解得x:y=3:2。

 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案【题目】如图,利用培养皿探究SO2的性质,实验时向Na2SO3固体上滴几滴浓硫酸,立即用另一表面扣在上面。表中对实验现象的描述或解释不正确的是
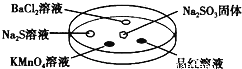
选项 | 实验现象 | 解释 |
A | BaCl2溶液变浑浊 | SO2与BaCl2溶液反应产生了BaSO3沉淀 |
B | Na2S溶液变浑浊 | SO2与Na2S溶液反应产生了S单质 |
C | 酸性KMnO4溶液褪色 | SO2具有还原性 |
D | 品红溶液褪色 | SO2具有漂白性 |
A. A B. B C. C D. D