题目内容
【题目】目前世界上60%的镁是从海水中提取的。海水提镁的主要流程如下:

请同答下列问题:
(1)石灰乳是生石灰与水形成的化合物,从充分利用海洋化学资源,提高经济效益的角度考虑,生产生石灰的主要原料来源于海洋中的________,其生产方程式___________。从离子反应的角度思考,往海水中加入石灰乳的作用是______________。
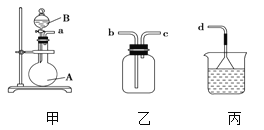
(2)操作A是____,操作B是______。
(3)加入的足量试剂a是_______(填化学式)。
(4)无水MgCl2在熔融状态下,通电后会产生Mg和Cl2,该反应的化学方程式为___________,从考虑成本和废物循环利用的角度,副产物氯气可以用于____________。
【答案】(1)贝壳(或牡蛎壳等) CaCO3![]() CaO +CO2↑;沉淀Mg2+ ;
CaO +CO2↑;沉淀Mg2+ ;
(2)过滤;蒸发浓缩、冷却结晶;(3)HCl;
(4)MgCl2(熔融) ![]() Mg+Cl2↑ 制盐酸,循环使用(方程式2分,其余每空1分)
Mg+Cl2↑ 制盐酸,循环使用(方程式2分,其余每空1分)
【解析】
试题分析:(1)石灰乳是生石灰与水形成的化合物,从充分利用海洋化学资源,提高经济效益的角度考虑,生产生石灰的主要原料来源于海洋中的贝壳(或牡蛎壳等),这些碳酸盐发生分解反应产生CaO和CO2,其生产方程式是CaCO3![]() CaO +CO2↑。从离子反应的角度思考,往海水中加入石灰乳的作用是与海水中的Mg2+反应结合形成Mg(OH)2,反应的离子方程式是Mg2++2OH-=Mg(OH)2↓。(2)操作A是从混合物中分离出难溶性的物质的操作方法是过滤;操作B是从可溶性的物质的水溶液中获得该物质晶体的方法,由于该物质的溶解度受温度的影响变化较大,所以该操作方法是蒸发浓缩、冷却结晶;(3)Mg(OH)2是碱,与HCl发生反应会产生MgCl2,所以加入的足量试剂a是HCl;(4)无水MgCl2在熔融状态下,通电后会产生Mg和Cl2,该反应的化学方程式为MgCl2(熔融)
CaO +CO2↑。从离子反应的角度思考,往海水中加入石灰乳的作用是与海水中的Mg2+反应结合形成Mg(OH)2,反应的离子方程式是Mg2++2OH-=Mg(OH)2↓。(2)操作A是从混合物中分离出难溶性的物质的操作方法是过滤;操作B是从可溶性的物质的水溶液中获得该物质晶体的方法,由于该物质的溶解度受温度的影响变化较大,所以该操作方法是蒸发浓缩、冷却结晶;(3)Mg(OH)2是碱,与HCl发生反应会产生MgCl2,所以加入的足量试剂a是HCl;(4)无水MgCl2在熔融状态下,通电后会产生Mg和Cl2,该反应的化学方程式为MgCl2(熔融) ![]() Mg+Cl2↑,从考虑成本和废物循环利用的角度,副产物氯气可以用于制盐酸,氯气可用于水的消毒、制取漂白粉等。
Mg+Cl2↑,从考虑成本和废物循环利用的角度,副产物氯气可以用于制盐酸,氯气可用于水的消毒、制取漂白粉等。