题目内容
已知氧化性:Br2>Fe3+>I2,向含有a mol FeI2的溶液中加入含b mol Br2的溴水,下列判断或相应的离子方程式正确的是
| A.当a=2,b=1时,离子方程式为:2Fe2++Br2→2Fe3++2Br- |
| B.如果反应后的溶液中存在c(Fe2+)=c(Fe3+),则4/5<a/b<1 |
| C.当a=1,b=2时,离子方程式为:2Fe2++4I-+3Br2→2Fe3++2I2+6Br- |
| D.当a=2,2<b<3时,溶液中铁元素以两种离子形式存在,且一定是c(Fe3+)>c(Fe2+) |
C
试题分析:A选项,根据题意可知,还原性I->Fe2+>Br-,故离子反应方程式为2I-+Br2=2Br-+I2。B选项,若反应后的溶液中存在c(Fe2+)=c(Fe3+),则发生反应方程式为4FeI2+5Br2=4I2+10Br-+2Fe2++2Fe3+,故只有在a/b=4/5时满足,故错误。C选项,正确。D选项,当a=2,b=2时,溶液中全部为Fe2+。当a=2,b=3时,溶液中有1/2Fe2+,故当a=2,2<b<3时,溶液中铁元素以两种离子形式存在且一定是c(Fe3+)<c(Fe2+)。

练习册系列答案
 孟建平小学滚动测试系列答案
孟建平小学滚动测试系列答案
相关题目
 CH3COOH+OH-
CH3COOH+OH- CuS(s)+2OH-
CuS(s)+2OH- 2OHˉ + Cl2↑+ H2↑
2OHˉ + Cl2↑+ H2↑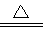 Cu2++ SO2↑+ 2H2O
Cu2++ SO2↑+ 2H2O H2↑+C12↑
H2↑+C12↑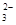 + 2H+== CO2 ↑ + H2O
+ 2H+== CO2 ↑ + H2O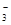 == Cu2+ + NO↑ + H2O
== Cu2+ + NO↑ + H2O +H2↑
+H2↑ +Ba2+=BaSO4↓
+Ba2+=BaSO4↓ +4H+=Cu2++NO↑+2H2O
+4H+=Cu2++NO↑+2H2O