题目内容
【题目】溶液 X 中可能含有 Ba2+、NH4+、Na+、K+、Cl-、HCO3-、HSO3-、SO42-中的几种离子,各离子的浓度均相等。为了确定其组成,某同学进行了如图所示的实验,下列说法正确的是
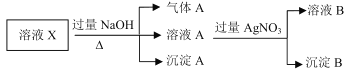
A.溶液 X中 Ba2+、NH4+、HCO3-、HSO3-一定存在
B.溶液 X中一定不存在SO42-、可能含有Cl-
C.是否存在Na+和K+需通过焰色反应进一步确认
D.沉淀A一定是BaCO3,沉淀B一定是AgCl
【答案】A
【解析】
X与过量NaOH反应生成气体A为NH3,沉淀A应为BaSO3或BaCO3或二者都存在,则溶液中一定含Ba2+、NH4+,HSO3-、HCO3-至少有一种,Ba2+、SO42-会形成BaSO4沉淀,不能大量共存,则含有Ba2+就一定不含SO42-,溶液A与硝酸银反应生成沉淀B可能为Ag2O或AgCl,溶液B含硝酸钠,由于各离子的浓度均相等,由电荷守恒可知,应含阴离子为Cl-、HCO3-,不含Na+、K+,沉淀A成分为BaSO3和BaCO3,以此来解答。
综上所述可知:溶液中一定含有Ba2+、NH4+、HCO3-、HSO3-、Cl-,一定不含有SO42-、Na+、K+。
A.由上述分析可知,X中Ba2+、NH4+、HCO3-、HSO3-一定存在,A正确;
B.溶液X中一定不存在SO42-、一定含有Cl-,B错误;
C.由电荷守恒可知,不含Na+、K+,不需要进行焰色反应,C错误;
D.沉淀A应为BaSO3和BaCO3,由于NaOH过量,所以沉淀B含有Ag2O,原溶液中含有Cl-,则沉淀B中也一定含有AgCl,D错误;
故合理选项是A。

练习册系列答案
 赢在课堂名师课时计划系列答案
赢在课堂名师课时计划系列答案
相关题目