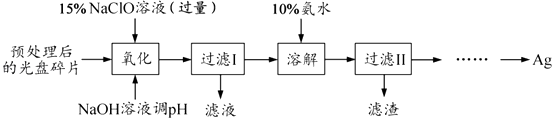
题目内容
【题目】(12分)碱式氯化铜是重要的无机杀菌剂.
(1)碱式氯化铜有多种制备方法
①方法1:45~50℃时,向CuCl悬浊液中持续通入空气得到Cu2 (OH)2 Cl23H2O,该反应的化学方程式为 .
②方法2:先制得CuCl2 , 再与石灰乳反应生成碱式氯化铜.Cu与稀盐酸在持续通入空气的条件下反应生成CuCl2 , Fe3+对该反应有催化作用,其催化原理如图所示. M′的化学式为 . 
(2)碱式氯化铜有多种组成,可表示为Cua(OH)bClcxH2O. 为测定某碱式氯化铜的组成,进行下列实验:
①称取样品1.1160g,用少量稀HNO3溶解后配成100.00mL溶液A;
②取25.00mL溶液A,加入足量AgNO3溶液,得AgCl 0.1722g;
③另取25.00mL溶液A,调节pH 4~5,用浓度为0.08000molL﹣1的EDTA(Na2H2Y2H2O)标准溶液滴定Cu2+ (离子方程式为Cu2++H2Y2﹣═CuY2﹣+2H+),滴定至终点,消耗标准溶液30.00mL.通过计算确定该样品的化学式(写出计算过程).
【答案】
(1)4CuCl+O2+8H2O ![]() 2Cu2(OH)2Cl2?3H2O;Fe2+
2Cu2(OH)2Cl2?3H2O;Fe2+
(2)
n(Cl﹣)=n(AgCl)× ![]() =
= ![]() =4.800×10﹣3mol,
=4.800×10﹣3mol,
n(Cu2+)=n(EDTA)× ![]() =0.08000 molL﹣1×30.00 mL×10﹣3 LmL﹣1×
=0.08000 molL﹣1×30.00 mL×10﹣3 LmL﹣1× ![]() =9.600×10﹣3 mol,
=9.600×10﹣3 mol,
n(OH﹣)=2n(Cu2+)﹣n(Cl﹣)=2×9.600×10﹣3 mol﹣4.800×10﹣3 mol=1.440×10﹣2 mol,
m(Cl﹣)=4.800×10﹣3 mol×35.5 gmol﹣1=0.1704 g,
m(Cu2+)=9.600×10﹣3 mol×64 gmol﹣1=0.6144 g,
m(OH﹣)=1.440×10﹣2 mol×17 gmol﹣1=0.2448 g,
n(H2O)= ![]() =4.800×10﹣3 mol,
=4.800×10﹣3 mol,
则a:b:c:x=n(Cu2+):n(OH﹣):n(Cl﹣):n(H2O)=2:3:1:1,
即化学式为Cu2 (OH)3ClH2O,
答:该样品的化学式为Cu2 (OH)3ClH2O.
【解析】解:(1)①45~50℃时,向CuCl悬浊液中持续通入空气得到Cu2 (OH)2 Cl23H2O,反应物为CuCl、氧气、水,Cu元素的化合价升高,O元素的化合价降低,由原子、电子守恒可知反应为4CuCl+O2+8H2O ![]() 2Cu2(OH)2Cl23H2O,
2Cu2(OH)2Cl23H2O,
所以答案是:4CuCl+O2+8H2O ![]() 2Cu2(OH)2Cl23H2O;
2Cu2(OH)2Cl23H2O;
②Fe3+对该反应有催化作用,结合图可知,Cu元素的化合价升高,则M中Fe元素的化合价降低,可知M′的化学式为Fe2+ ,
所以答案是:Fe2+;(2)n(Cl﹣)=n(AgCl)× ![]() =
= ![]() =4.800×10﹣3mol,
=4.800×10﹣3mol,
n(Cu2+)=n(EDTA)× ![]() =0.08000 molL﹣1×30.00 mL×10﹣3 LmL﹣1×
=0.08000 molL﹣1×30.00 mL×10﹣3 LmL﹣1× ![]() =9.600×10﹣3 mol,
=9.600×10﹣3 mol,
n(OH﹣)=2n(Cu2+)﹣n(Cl﹣)=2×9.600×10﹣3 mol﹣4.800×10﹣3 mol=1.440×10﹣2 mol,
m(Cl﹣)=4.800×10﹣3 mol×35.5 gmol﹣1=0.1704 g,
m(Cu2+)=9.600×10﹣3 mol×64 gmol﹣1=0.6144 g,
m(OH﹣)=1.440×10﹣2 mol×17 gmol﹣1=0.2448 g,
n(H2O)= ![]() =4.800×10﹣3 mol,
=4.800×10﹣3 mol,
则a:b:c:x=n(Cu2+):n(OHspan>﹣):n(Cl﹣):n(H2O)=2:3:1:1,
即化学式为Cu2 (OH)3ClH2O,
答:该样品的化学式为Cu2 (OH)3ClH2O.

 巧学巧练系列答案
巧学巧练系列答案