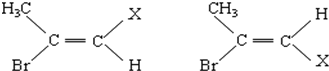题目内容
11.下列各组离子在一定条件下能够大量共存的是( )| A. | 无色溶液:Cu2+、K+、MnO4-、SO42- | |
| B. | 能溶解Al2O3的溶液:Na+、Ca2+、HCO3-、NO3- | |
| C. | 常温下c(OH-)=1×10-13mol•L-1的溶液:NH4+、Al3+、SO42-、Cl- | |
| D. | 含0.1 mol•L-1 NO3-的溶液:H+、Fe2+、Mg2+、Br- |
分析 A.有颜色的离子不能大量共存;
B.能溶解Al2O3的溶液为强碱或强酸溶液;
C.常温下c(OH-)=1×10-13mol•L-1的溶液,水的电离受到抑制,溶液可能呈酸性,也可能呈碱性;
D.酸性条件下NO3-具有强氧化性.
解答 解:A.Cu2+、MnO4-有颜色,不能大量共存,故A错误;
B.能溶解Al2O3的溶液为强碱或强酸溶液,无论酸性还是碱性,HCO3-都不能大量共存,故B错误;
C.常温下c(OH-)=1×10-13mol•L-1的溶液,水的电离受到抑制,溶液可能呈酸性,也可能呈碱性,酸性条件下,离子之间不发生任何反应,可大量共存,故C正确;
D.酸性条件下NO3-具有强氧化性,与Fe2+发生氧化还原反应,不能大量共存,故D错误.
故选C.
点评 本题考查离子的共存,为高频考点,把握习题中的信息及常见离子之间的反应为解答的关键,侧重复分解反应及氧化还原反应的离子共存考查,题目难度不大.

练习册系列答案
相关题目
1.为了除去硫酸铜溶液中含有的Fe2+杂质,先加入合适的氧化剂使Fe2+氧化为Fe3+,下列物质中最好选用( )
| A. | KMnO4溶液 | B. | H2O2溶液 | C. | 氯水 | D. | HNO3溶液 |
2.下列粒子属等电子体的是( )
| A. | NO和O2 | B. | CH4和NH4+ | C. | NH2?和H2O2 | D. | HCl和H2O |
19.下列描述正确的是( )
| A. | 硝酸的标签上应标注 和 和 | B. | 硫离子结构示意图: | ||
| C. | HClO的电子式: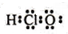 | D. | 239Pu比235U原子核内多4个中子 |
3.下列物质既能发生消去反应生成相应的烯烃,又能氧化生成相应醛的是( )
| A. | CH3OH | B. | CH3CH2CH2OH | C. | 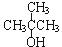 | D. | 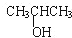 |
1.铜锌合金俗称黄铜.下列不易鉴别黄铜与真金的方法是( )
| A. | 测密度 | B. | 测熔点 | C. | 灼烧 | D. | 看外观 |
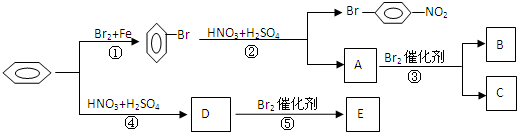
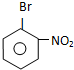 B
B 或
或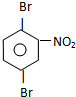 C
C E
E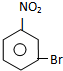
 .
.