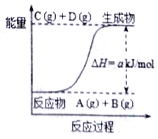
题目内容
【题目】某课外小组分别用如图所示装置对原电池和电解原理进行实验探究. 请回答:
Ⅰ.用图 1 所示装置进行第一组实验.
(1)在保证电极反应不变的情况下,不能替代 Cu 作电极的是(填字母序号).
(2)N 极发生反应的电极反应式为 . Ⅱ.用图 2 所示装置进行第二组实验.实验过程中,观察到与第一组实验不同的现象:两极 均有气体产生,Y 极区溶液逐渐变成紫红色;停止实验,铁电极明显变细,电解液仍然澄清. 查阅资料得知,高铁酸根离子(FeO42﹣)在溶液中呈紫红色.
(3)电解过程中,X 极区溶液的 pH(填“增大”“减小”或“不变”).
(4)电解过程中,Y 极发生的电极反应之一为 Fe﹣6e﹣+8OH﹣═Fe4O2﹣+4H2O 若在 X 极收集到672mL 气体,在 Y 极收集到 168mL 气体(均已折算为标准状况时气体体积),则 Y 电极(铁 电极)质量减少g.
(5)在碱性锌电池中,用高铁酸钾作为正极材料,电池反应为 2K2FeO4+3Zn═Fe2O3+ZnO+2K2ZnO2 . 该电池正极发生的反应的电极反应式为 . 
【答案】
(1)A
(2)2H2O+2e﹣═H2↑+2OH﹣
(3)增大
(4)0.28
(5)2FeO42﹣+6e﹣+5H2O═Fe2O3+10OH﹣
【解析】解:(1)在保证电极反应不变的情况下,仍然是锌作负极,则正极材料必须是不如锌活泼的金属或导电的非金属,铝是比锌活泼的金属,所以不能代替铜,
所以答案是:A;(2)N电极连接原电池负极,所以是电解池阴极,阴极上氢离子得电子发生还原反应,电极反应式为:2H++2e﹣═H2↑(或2H2O+2e﹣═H2↑+2OH﹣),
所以答案是:2H2O+2e﹣═H2↑+2OH﹣;(3)电解过程中,阴极上氢离子放电生成氢气,则阴极附近氢氧根离子浓度大于氢离子溶液,溶液呈碱性,溶液的pH增大,所以答案是:增大;(4)X电极上析出的是氢气,Y电极上析出的是氧气,且Y电极失电子进入溶液,设铁质量减少为xg,根据转移电子数相等得 ![]() ×2=
×2= ![]() +
+ ![]() ,x=0.28,所以答案是:0.28;(5)正极上高铁酸根离子得电子发生还原反应,反应方程式为2FeO42﹣+6e﹣+5H2O═Fe2O3+10OH﹣,所以答案是:2FeO42﹣+6e﹣+5H2O═Fe2O3+10OH﹣.
,x=0.28,所以答案是:0.28;(5)正极上高铁酸根离子得电子发生还原反应,反应方程式为2FeO42﹣+6e﹣+5H2O═Fe2O3+10OH﹣,所以答案是:2FeO42﹣+6e﹣+5H2O═Fe2O3+10OH﹣.

 寒假乐园北京教育出版社系列答案
寒假乐园北京教育出版社系列答案【题目】下表为元素周期表的一部分:
周期 族 | ||||||||
1 | ① | |||||||
2 | ② | |||||||
3 | ③ | ④ | ⑤ | ⑥ | ||||
请参照元素①-⑥在表中的位置,用化学用语回答下列问题:
(1)画出元素②的离子结构示意图_________。
(2)②、③、⑤的离子半径由大到小的顺序为___________。
(3)元素④和⑥形成的化合物的电子式:_____________。
(4)元素②和⑤形成的化合物的化学式为____________。
【题目】亚硝酸氯(ClNO)可由NO与Cl2在通常条件下反应得列,化学方塑式为2NO(g) + Cl2(g)![]() 2ClNO(g)。
2ClNO(g)。
(1)在一定温度下,该反应于一恒容密闭容器中达到平衡,继续通入Cl2,逆反应速率_____( 填增大、减少、不变).
(2)己知几种化学键的键能数据如下表( 亚硝酸氯的结构为Cl-N=O)
化学键 | N≡O | Cl一Cl | Cl一N | N=O |
键能/kJ.mol-1 | 630 | 243 | a | 607 |
2NO(g)+Cl2(g)![]() 2ClNO(g) △H=-111kJ/mol,则a=_______。
2ClNO(g) △H=-111kJ/mol,则a=_______。
(3)在1L的恒容密闭容器中充入2molNO(g)和1mol Cl2(g),在不同温度下测得c(ClNO)与时间的关系如图A:
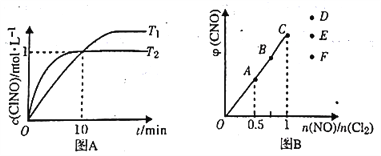
①该反应的△H_____0(填“>”“<”或“=”)。
②反应开始到10min 时NO 的平均反应速率v( NO) =________mol/(L.min).
③T2时该反应的平衡常数K=________。
(4)一定条件下在恒温恒容的密闭容器中按一定比例充入NO(g)和Cl2(g),平衡时ClNO的体积分数随n(NO)/n(Cl2)的变化图象如图B,则A、B、C 三状态中,NO 的转化率最大的是___点,当n(NO)/n(Cl2)=1.5时,达到平街状态ClNO 的体积分数可能是D、E、F三点中的______点。
【题目】废旧印刷电路板的回收利用可实现资源再生,并减少污染.
(1)用H2O2和H2SO4的混合溶液可溶出印刷电路板金属粉末中的铜.已知:
Cu(s)+2H+(aq)=Cu2+(aq)+H2(g)△H=+64.39kJmol﹣1
2H2O2(l)=2H2O(l)+O2(g)△H=﹣196.46kJmol﹣1
H2(g)+ ![]() O2(g)=H2O(l)△H=﹣285.84kJmol﹣1
O2(g)=H2O(l)△H=﹣285.84kJmol﹣1
在 H2SO4溶液中Cu与H2O2反应生成Cu2+和H2O的热化学方程式为 .
(2)控制其他条件相同,印刷电路板的金属粉末用10%H2O2和3.0mol/LH2SO4的混合溶液处理,测得不同温度下铜的平均溶解速率(见表).
温度(℃) | 20 | 30 | 40 | 50 | 60 | 70 | 80 |
铜平均溶解速率 | 7.34 | 8.01 | 9.25 | 7.98 | 7.24 | 6.73 | 5.76 |
当温度高于40℃时,铜的平均溶解速率随着反应温度升高而下降,其主要原因是 .
(3)在提纯后的CuSO4溶液中加入一定量的Na2SO3和NaCl溶液,加热,生成CuCl沉淀.制备CuCl的离子方程式是 .