题目内容
【题目】亚硝酸氯(ClNO)可由NO与Cl2在通常条件下反应得列,化学方塑式为2NO(g) + Cl2(g)![]() 2ClNO(g)。
2ClNO(g)。
(1)在一定温度下,该反应于一恒容密闭容器中达到平衡,继续通入Cl2,逆反应速率_____( 填增大、减少、不变).
(2)己知几种化学键的键能数据如下表( 亚硝酸氯的结构为Cl-N=O)
化学键 | N≡O | Cl一Cl | Cl一N | N=O |
键能/kJ.mol-1 | 630 | 243 | a | 607 |
2NO(g)+Cl2(g)![]() 2ClNO(g) △H=-111kJ/mol,则a=_______。
2ClNO(g) △H=-111kJ/mol,则a=_______。
(3)在1L的恒容密闭容器中充入2molNO(g)和1mol Cl2(g),在不同温度下测得c(ClNO)与时间的关系如图A:
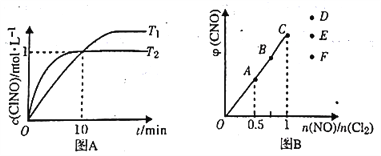
①该反应的△H_____0(填“>”“<”或“=”)。
②反应开始到10min 时NO 的平均反应速率v( NO) =________mol/(L.min).
③T2时该反应的平衡常数K=________。
(4)一定条件下在恒温恒容的密闭容器中按一定比例充入NO(g)和Cl2(g),平衡时ClNO的体积分数随n(NO)/n(Cl2)的变化图象如图B,则A、B、C 三状态中,NO 的转化率最大的是___点,当n(NO)/n(Cl2)=1.5时,达到平街状态ClNO 的体积分数可能是D、E、F三点中的______点。
【答案】 增大 200 < 0.1 2 A D
【解析】(1)在一定温度下,该反应于一恒容密闭容器中达到平衡,继续通入Cl2,压强增大,逆反应速率增大;(2)2NO(g)+Cl2(g)![]() 2ClNO(g) 反应的△H=反应物的键能之和-生成物的键能之和=(2×630+243)-(2a+2×607)=-111kJ/mol,解得a=200;
2ClNO(g) 反应的△H=反应物的键能之和-生成物的键能之和=(2×630+243)-(2a+2×607)=-111kJ/mol,解得a=200;
(3)①根据图像,T2>T1,降低温度c(C1NO)增大,说明平衡向正反应方向移动,说明正反应是放热反应,△H<0;
②反应开始到10min时,c(C1NO)=1mol/L,则v(C1NO)= ![]() =0.1mol/(L·min),则NO的平均反应速率v(NO)=v(C1NO)=0.1mol/(L·min);
=0.1mol/(L·min),则NO的平均反应速率v(NO)=v(C1NO)=0.1mol/(L·min);
③ 2NO(g)+Cl2(g) ![]() 2ClNO(g)
2ClNO(g)
起始(mol/L) 2 1 0
改变(mol/L) 1 0.5 1
平衡(mol/L) 1 0.5 1
T2时该反应的平衡常数K=![]() =
=![]() =2;
=2;
(4)n(NO)/n(C12)的比值越小,NO的转化率越大,NO的转化率最大的是A点,根据曲线的变化趋势,当n(NO)/n(C12)=1.5,达到平衡状态ClNO的体积分数是D。