题目内容
【题目】对下列实验的描述不正确的是( )
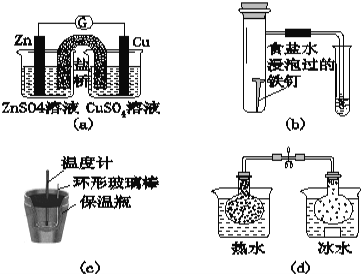
A.图(a)所示的实验:根据检流计(G)中指针偏转的方向比较Zn、Cu的金属活泼性
B.图(b)所示的实验:根据小试管中液面的变化判断铁钉发生析氢腐蚀
C.图(c)所示的实验:根据温度计读数的变化用稀盐酸和稀NaOH溶液反应测定中和热
D.图(d)所示的实验:根据两烧瓶中气体颜色的变化判断2NO2(g)![]() N2O4(g)是放热反应
N2O4(g)是放热反应
【答案】B
【解析】
试题分析:A. 图(a)所示的装置能够构成原电池,有电流通过,因此可以利用检流计(G)中指针偏转的方向比较Zn、Cu的金属活泼性,A正确;B. 图(b)所示的实验中,用食盐水浸泡过的铁钉发生的是吸氧腐蚀,B错误;C.图(c)所示的实验:根据温度计读数的变化用稀盐酸和稀NaOH溶液反应测定中和热,C正确;D.图(d)所示的实验:冰水中颜色浅,热水中颜色深,因此根据两烧瓶中气体颜色的变化判断2NO2(g)![]() N2O4(g)是放热反应,D正确。故答案B。
N2O4(g)是放热反应,D正确。故答案B。

 阅读快车系列答案
阅读快车系列答案【题目】煤化工中常需研究不同温度下平衡常数、投料比等问题。
已知:CO(g)+H2O(g)![]() H2(g)+CO2(g)平衡常数K随温度的变化如下表:
H2(g)+CO2(g)平衡常数K随温度的变化如下表:
温度/℃ | 400 | 500 | 800 |
平衡常数K | 9.94 | 9 | 1 |
回答下列问题
(1)该反应的平衡常数表达式K= ,△H 0(填“<”、“>”、“=”)
(2)已知在一定温度下,C(s)+CO2(g)![]() 2CO(g)平衡常数K1
2CO(g)平衡常数K1
C(s)+H2O(g)![]() H2(g)+CO(g)平衡常数K2,
H2(g)+CO(g)平衡常数K2,
则K、K1、K2,之间的关系是 。
(3)800℃时,向一个10L的恒容反应器中充入0.40molCO和1.60mol水蒸气,经一段时 间后反应达到平衡,此时CO的转化率为 ;若保持其他条件不变,向平衡体系中再通入0.10molCO和0.40mol CO2,此时v正 v逆 (填“>”、“=”或“<”).