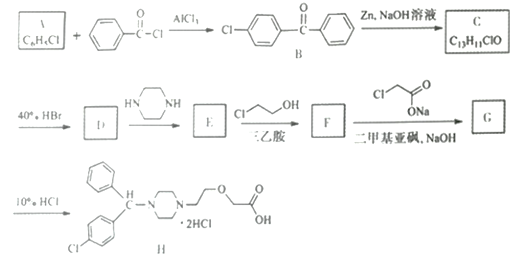
题目内容
【题目】设阿伏加德罗常数为6.02×1023mol-1 。关于1mol H2O的叙述正确的是
A.含有1mol H2B.含有6.02×1023个水分子
C.质量为18 g/molD.在标准状况下的体积为22.4 L
【答案】B
【解析】
A、H2O中不含H2,故A错误;
B、1mol H2O含有阿伏加德罗常数个水分子,故B正确;
C、1mol H2O的质量为18 g,故C错误;
D、标准状况下水为液体,故D错误。
答案选B。

 阅读快车系列答案
阅读快车系列答案【题目】CuCl广泛应用于化工和印染等行业。在实验室中模拟热分解CuCl2·xH2O制备CuCl的原理和实验装置如下: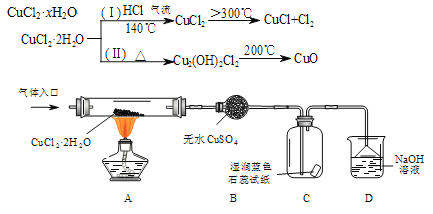
完成下列填空:
(1)在实验(Ⅰ)过程中,观察到B中固体由白色变为蓝色,C中产生的现象是__________,导致该现象的物质是________________________。
(2)装置D的作用是___________________________________,其中发生氧化还原反应的化学方程式是_____________________________________。
(3)反应结束后,CuCl产品中可能存在少量的CuCl2或CuO杂质。
①若杂质是CuCl2,则原因是_________________________________________。
②若杂质是CuO,则原因是__________________________________________。
(4)根据实验(Ⅱ),测定CuCl2·xH2O中结晶水的含量。取CuCl2·xH2O样品1.692g,经过3次灼烧、冷却、称量,得到黑色固体的质量数据如下:
称 量 | 第1次 | 第2次 | 第3次 |
质量(g) | 0.820g | 0.800g | 0.800g |
则x=_____________(保留2位小数)。
【题目】用酸式滴定管准确移取25.00mL,某未知浓度的盐酸溶液于一洁净的锥形瓶中,然后用0.20molL﹣1的氢氧化钠溶液(指示剂为酚酞)滴定得结果如表
NaOH起始读数 | NaOH终点读数 | |
第一次 | 0.10ml | 20.30ml |
第二次 | 0.30ml | 20.10ml |
(1)根据以上数据可以计算出盐酸的物质的量浓度为 molL﹣1 .
(2)在配制250mL0.20molL﹣1的氢氧化钠标准溶液时,用到的仪器除托盘天平、烧杯、玻璃棒还有 .
(3)以下操作造成测定结果偏高的有 .
A.配制标准溶液的氢氧化钠固体中混有KOH杂质
B.滴定终点读数时,俯视滴定管的刻度,其它操作均正确
C.盛装未知液的锥形瓶用蒸馏水洗过,未用待测液润洗
D.滴定到终点读数时发现滴定管尖嘴处悬挂一滴溶液
E.未用标准液润洗碱式滴定管.