��Ŀ����
����Ŀ��ICl(�Ȼ���)����ɫҺ�壬�۵�13.9�棬�е�97 4�棬��ˮ�⣬�Ӵ�����ʱ���γ����������⣬��������ʷ������ã������Ҵ������ѵȡ�ijУ�о���ѧϰС���ͬѧ�������������Ʊ��Ȼ��⡣�ش��������⣺
![]()
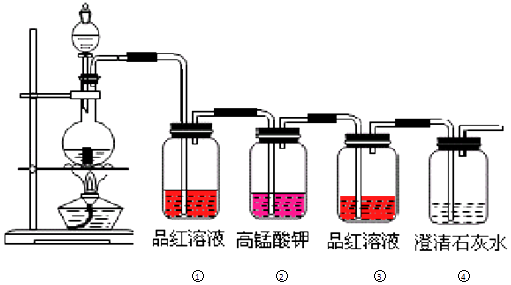
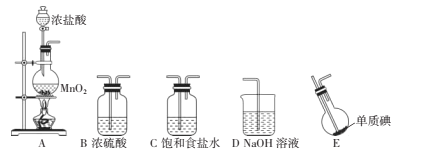
(1)���Aװ�������Եķ���Ϊ ___��
(2)����װ�ã��������������ӵ�˳��Ϊ____��װ�ÿ��ظ�ʹ�ã���A�з�����Ӧ�����ӷ���ʽΪ____��
(3)Cװ�õ�������____��
(4)Eװ�õ���ƿ��Ӧʱ�����ˮ�У������¶ȴ�Լ40�棬��Ŀ����____��
(5)���������Ӻõ�װ�ý���ʵ�飬ʵ�鲽�����£�
�ټ��װ�������Ժ�װ��ҩƷ �ڴ�Һ©������ �۹رշ�Һ©������ ��ֹͣ����E�������ȴ ��ˮԡ����E
�밴��ȷ��˳������������������____��
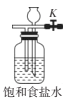
(6)��Aװ�ú��������ͼ��װ�ã�����Ӧ�����رշ�Һ©�������ر�K����װ�õ�������____��
![]()
(7)IC1��ˮ��Ӧ�Ļ�ѧ����ʽΪ____��
���𰸡� ��A�ĵ��ܿ�����һ����������ˮ�У��رշ�Һ©����ť������Բ����ƿ�������ܿ�������ð�����ַſ���ƿ����һ��ˮ�������뵼�ܣ�˵��Aװ������������ ACBEBD MnO2+4H++2Cl-=Mn2++Cl2��+2H2O ��ȥCl2�л��е�HCl ����I2��������ICl�Ļӷ� �٢ڢݢܢ� ��������Cl2 IC1+H2O=HIO+HCl
��������(1)������ˮ������Aװ�������Լ�飬���巽�����£���A�ĵ��ܿ�����һ����������ˮ�У��رշ�Һ©����ť������Բ����ƿ�������ܿ�������ð�����ַſ���ƿ����һ��ˮ�������뵼�ܣ�˵��Aװ�����������ã���ȷ�𰸣���A�ĵ��ܿ�����һ����������ˮ�У��رշ�Һ©����ť������Բ����ƿ�������ܿ�������ð�����ַſ���ƿ����һ��ˮ�������뵼�ܣ�˵��Aװ�����������á�
(2)���ö���������Ũ��������Ʊ������������к����Ȼ��⡢ˮ�������ʣ���˻��������ͨ������ʳ��ˮ��Һ����ȥ�Ȼ��⣬��ͨ��Ũ�����ȥˮ�������õ����﴿�����������������뵽װ��E�У������з�Ӧ������ICl(�Ȼ���)����ɫҺ�壬 ��ˮ�⣬���Ի���������װ��B���������β������Һ���գ��������������ӵ�˳��ΪACBEBD��A�з�����ӦΪ����������Ũ��������Ʊ����������ӷ���ʽΪMnO2+4H++2Cl-=Mn2++Cl2��+2H2O����ȷ�𰸣�ACBEBD�� MnO2+4H++2Cl-=Mn2++Cl2��+2H2O��
(3)�����Ʊ����������к����Ȼ������壬�ñ���ʳ��ˮ��ȥ�Ȼ��⣬���Cװ�õ������dz�ȥCl2�л��е�HCl����ȷ�𰸣� ��ȥCl2�л��е�HCl��
4) �Ȼ������ɫҺ�壬�۵�13.9�棬�е�97 4�棬������Ϣ��֪ICl�ӷ����¶ȸӷ��Ŀ죬ͬʱ���ʵ�Ҳ�������������Eװ�õ���ƿ��Ӧʱ�����ˮ�У������¶ȴ�Լ40�棬�Լ���I2��������ICl�Ļӷ�����ȷ�𰸣�����I2��������ICl�Ļӷ���
5) װ�����Ӻú������ȼ��װ�õ�����������©����������ҩƷ����Һ©����������Ӧ��ʼ��������ˮԡ����װ��E���ȣ���Ӧ������ֹͣ����E�������ȴ���������º�Һ©�������ڹرգ� ��ȷʵ�鲽��Ϊ�٢ڢݢܢۣ���ȷ�𰸣��٢ڢݢܢۡ�
(6)��Aװ�ú��������ͼ��װ�ã�����Ӧ�����رշ�Һ©�������ر�K����װ�ÿ���������������Cl2 �������ͷŵ���������Ⱦ��������ȷ������������Cl2 ��
(7) IC1����ˮ�⣬��������ʹε��ᣬ��Ӧ�Ļ�ѧ����ʽΪ��IC1+H2O=HIO+HCl����ȷ�𰸣�IC1+H2O=HIO+HCl��

 ֥�鿪���γ�������ϵ�д�
֥�鿪���γ�������ϵ�д�