题目内容
【题目】某温度时,在一个2L的密闭容器中,X、Y、Z三种气体物质的物质的量随时间的变化曲线如图所示。根据图中数据填空:
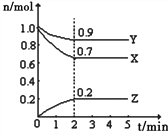
(1)该反应的化学方程式为____。
(2)反应开始至2min,以气体X表示的平均反应速率为____。反应达限度时,Y的转化率为____,反应开始时与反应达平衡状态时的压强之比为____。
(3)若上述反应在甲、乙两个相同容器内同时进行,分别测得甲中v(X)=9 mol/(L·min),乙中v(Y)=0.1 mol/(L·s),则____中反应更快。
【答案】 3X+Y![]() 2Z 0.075mol/(L·min) 10% 10:9 乙
2Z 0.075mol/(L·min) 10% 10:9 乙
【解析】(1)由图象可以看出,X、Y的物质的量逐渐减小,Z的物质的量逐渐增大,则X、Y为反应物,Z为生成物,2min后,X、Y的物质的量为定值且不为零,为可逆反应,相同时间内物质的量的变化比值为:△n(X)︰△n(Y)︰△n(Z)=(1.0-0.7)mol︰(1.0-0.9)mol:0.2mol=3︰1︰2,则化学方程式为3X+Y![]() 2Z;
2Z;
(2)反应开始至2min,以气体X表示的平均反应速率为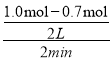 =0.075mol/(L·min);反应达限度时,Y的转化率为
=0.075mol/(L·min);反应达限度时,Y的转化率为![]() ×100%=10%;反应开始时总物质的量为2mol,平衡时总物质的量为1.8mol,根据阿伏加德罗定律可知,在恒温恒容条件下,容器内压强与气体总物质的量成正比,则反应开始时与反应达平衡状态时的压强之比为2mol:1.8mol=10:9;
×100%=10%;反应开始时总物质的量为2mol,平衡时总物质的量为1.8mol,根据阿伏加德罗定律可知,在恒温恒容条件下,容器内压强与气体总物质的量成正比,则反应开始时与反应达平衡状态时的压强之比为2mol:1.8mol=10:9;
(3)甲中v(X)=9 mol/(L·min),乙中v(Y)=0.1 mol/(L·s),对应v(X)=v(Y)×3=0.3 mol/(L·s)=18mol/(L·min),则乙中反应更快。

练习册系列答案
相关题目