题目内容
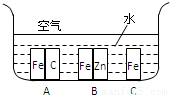
(Ⅰ)如图所示,铁处于Ⅰ、Ⅱ、Ⅲ三种不同的环境中,铁被腐蚀的速率由大到小的顺序是(填序号)______.(Ⅱ)据报道,全世界每年因金属腐蚀造成的直接经济损失约达7000亿美元,我国因金属腐蚀造成的损失占国民生产总值(GNP)的4%.
(1)请你根据不同原理,提出防止钢铁锈蚀的两条合理措施:
①______;②______.
(2)请写出用稀硫酸除去铁锈的化学反应方程式:______.
(3)向含有铬离子(Cr3+)的废水中加入石灰乳[Ca(OH)2],降低溶液的酸度.当调节废水的PH至8~9时,铬离子形成Cr(OH)3沉淀而分离,其反应的离子方程式是:______.
【答案】分析:(Ⅰ)金属腐蚀的速度:原电池的负极金属>金属的化学腐蚀>有保护措施的腐蚀;
(Ⅱ)(1)防止钢铁锈蚀关键是与氧气和水隔绝,把金属保护起来;
(2)稀硫酸可以和金属氧化物反应生成盐和水;
(3)根据铬离子(Cr3+)在PH至8~9时的溶液中,会形成Cr(OH)3沉淀来书写原理方程式.
解答:解:(Ⅰ)铁处于A的环境中做原电池的负极,腐蚀速率较快,铁处于B的环境中做原电池的正极,被保护,腐蚀速率很慢,铁处于C的环境中的金属铁发生吸氧腐蚀,速度较慢,
故答案为:A>C>B;
(Ⅱ)防止钢铁锈蚀关键是与氧气和水隔绝,可以进行表面防护处理(涂油、刷漆、表面镀金属等),还可以改变金属内部结构(制成不锈钢)等,
故答案为:改变金属内部结构(制成不锈钢);刷漆(涂油、表面镀金属);
(2)铁锈的主要成分是氧化铁,可以和酸反应生成盐和水,即Fe2O3+3H2SO4=Fe2(SO4)3+3H2O,故答案为:Fe2O3+3H2SO4=Fe2(SO4)3+3H2O;
(3)根据信息提示:铬离子(Cr3+)在pH至8~9时的溶液中,会形成Cr(OH)3沉淀,则和氢氧化钙的反应为:2Cr3++3Ca(OH)2=2Cr(OH)3+3Ca2+,
故答案为:2Cr3++3Ca(OH)2=2Cr(OH)3+3Ca2+.
点评:本题考查学生金属的腐蚀速率快慢比较、金属的生锈原理以及防护和氧化铁的性质等方面的知识,可以根据所学知识进行回答,难度不大.
(Ⅱ)(1)防止钢铁锈蚀关键是与氧气和水隔绝,把金属保护起来;
(2)稀硫酸可以和金属氧化物反应生成盐和水;
(3)根据铬离子(Cr3+)在PH至8~9时的溶液中,会形成Cr(OH)3沉淀来书写原理方程式.
解答:解:(Ⅰ)铁处于A的环境中做原电池的负极,腐蚀速率较快,铁处于B的环境中做原电池的正极,被保护,腐蚀速率很慢,铁处于C的环境中的金属铁发生吸氧腐蚀,速度较慢,
故答案为:A>C>B;
(Ⅱ)防止钢铁锈蚀关键是与氧气和水隔绝,可以进行表面防护处理(涂油、刷漆、表面镀金属等),还可以改变金属内部结构(制成不锈钢)等,
故答案为:改变金属内部结构(制成不锈钢);刷漆(涂油、表面镀金属);
(2)铁锈的主要成分是氧化铁,可以和酸反应生成盐和水,即Fe2O3+3H2SO4=Fe2(SO4)3+3H2O,故答案为:Fe2O3+3H2SO4=Fe2(SO4)3+3H2O;
(3)根据信息提示:铬离子(Cr3+)在pH至8~9时的溶液中,会形成Cr(OH)3沉淀,则和氢氧化钙的反应为:2Cr3++3Ca(OH)2=2Cr(OH)3+3Ca2+,
故答案为:2Cr3++3Ca(OH)2=2Cr(OH)3+3Ca2+.
点评:本题考查学生金属的腐蚀速率快慢比较、金属的生锈原理以及防护和氧化铁的性质等方面的知识,可以根据所学知识进行回答,难度不大.

练习册系列答案
相关题目








 (1)铜板上铁铆钉处容易生锈,称为
(1)铜板上铁铆钉处容易生锈,称为