题目内容
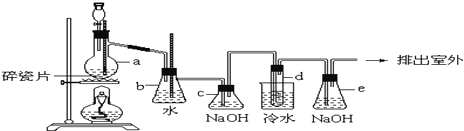
 已知实验室制取氯气是用二氧化锰和浓盐酸反应的原理,在收集时,若是用排水法,可能会损失部分氯气.
已知实验室制取氯气是用二氧化锰和浓盐酸反应的原理,在收集时,若是用排水法,可能会损失部分氯气.(1)写出用水收集氯气发生的反应方程式:
(2)受二氧化锰和浓盐酸反应中盐酸浓度对反应的影响的启发,某研究性学习小组决定对一定量浓度的硫酸与Zn的反应生成的气体的成分进行探究.
【提出假设】
小组同学经过分析讨论认为生成气体可能含H2和SO2.
①认为生成气体中含SO2的理由是
②该实验中发生的反应为:
(3)【设计实验方案,验证假设】主要包括两个环节:
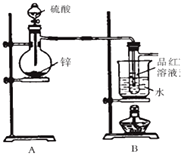
I.验证SO2,实验装置如图所示;
Ⅱ.检验产物中含有H2,实验内容为将由B部分导出的气体依次通过装置C、D、E、F、G.
①盛放锌粒的仪器名称是
②B部分装置的目的是验证SO2并探究SO2与品红作用的可逆性.水浴加热的优点是
Ⅱ中装置C、D、E、F、G的信息如下表所示:
| 仪器标号 | C | D | E | F | G |
| 仪器 | 洗气瓶 | 洗气瓶 | 硬质玻璃管,加热 | 干燥管 | 干燥管 |
| 仪器中所加物质 | NaOH溶液 | 浓硫酸 | CuO粉末 | 试剂X | 无水CaCl2固体 |
②试剂X是
考点:氯气的实验室制法
专题:实验题
分析:(1)氯气与水反应生成盐酸和次氯酸,次氯酸为弱酸;一般实验室收集氯气时用排饱和食盐水的方法依据化学平衡移动的理论解答;
(2)浓硫酸具有强的氧化性,与金属反应生成二氧化硫,稀硫酸与金属反应表现为酸性,反应生成氢气;
(3)①熟悉常见的仪器,了解名称;
②依据水浴加热的特点:受热均匀,易于控制温度解答;二氧化硫具有漂白性,能够使品红褪色,二氧化硫的漂白性具有不稳定的特点,加热容易恢复颜色;
Ⅱ要检验生成的气体含有氢气,则应该先除去反应生成的二氧化硫,二氧化硫为酸性氧化物,可以用氢氧化钠溶液吸收,然后用浓硫酸干燥剩余气体,再将剩余气体通入盛有氧化铜的硬质试管中加热,如果有氢气存在则反应生成水,能够使白色的无水硫酸铜变蓝.
(2)浓硫酸具有强的氧化性,与金属反应生成二氧化硫,稀硫酸与金属反应表现为酸性,反应生成氢气;
(3)①熟悉常见的仪器,了解名称;
②依据水浴加热的特点:受热均匀,易于控制温度解答;二氧化硫具有漂白性,能够使品红褪色,二氧化硫的漂白性具有不稳定的特点,加热容易恢复颜色;
Ⅱ要检验生成的气体含有氢气,则应该先除去反应生成的二氧化硫,二氧化硫为酸性氧化物,可以用氢氧化钠溶液吸收,然后用浓硫酸干燥剩余气体,再将剩余气体通入盛有氧化铜的硬质试管中加热,如果有氢气存在则反应生成水,能够使白色的无水硫酸铜变蓝.
解答:
解:(1)氯气与水反应生成盐酸和次氯酸,化学方程式为Cl2+H2OHCl+HClO;氯气与水反应为可逆反应,所以增大氯离子的浓度,促使平衡逆向移动,抑制了氯气的溶解,
故答案为:Cl2+H2OHCl+HClO;增大Cl-的浓度,平衡逆向移动,减少氯气的溶解量;
(2)浓硫酸具有强的氧化性,与金属反应生成二氧化硫,稀硫酸与金属反应表现为酸性,反应生成氢气,
故答案为:①实验所用的硫酸的浓度过大;
②Zn+2H2SO4=ZnSO4+SO2↑+H2O Zn+H2SO4=ZnSO4+H2↑;
(3)①盛放锌粒的仪器名称是:蒸馏烧瓶;
故答案为:蒸馏烧瓶;
②水浴加热的特点:受热均匀,易于控制温度;二氧化硫具有漂白性,能够使品红褪色,二氧化硫的漂白性具有不稳定的特点,加热容易恢复颜色;
故答案为:受热均匀,易于控制温度; 品红溶液先褪色,加热后又恢复红色;
Ⅱ要检验生成的气体含有氢气,则应该先除去反应生成的二氧化硫,二氧化硫为酸性氧化物,可以用氢氧化钠溶液吸收,然后用浓硫酸干燥剩余气体,再将剩余气体通入盛有氧化铜的硬质试管中加热,如果有氢气存在则反应生成水,能够使白色的无水硫酸铜变蓝,
故答案为:①吸收SO2;干燥H2,防止干扰后面H2的检验;②无水CuSO4粉末.
故答案为:Cl2+H2OHCl+HClO;增大Cl-的浓度,平衡逆向移动,减少氯气的溶解量;
(2)浓硫酸具有强的氧化性,与金属反应生成二氧化硫,稀硫酸与金属反应表现为酸性,反应生成氢气,
故答案为:①实验所用的硫酸的浓度过大;
②Zn+2H2SO4=ZnSO4+SO2↑+H2O Zn+H2SO4=ZnSO4+H2↑;
(3)①盛放锌粒的仪器名称是:蒸馏烧瓶;
故答案为:蒸馏烧瓶;
②水浴加热的特点:受热均匀,易于控制温度;二氧化硫具有漂白性,能够使品红褪色,二氧化硫的漂白性具有不稳定的特点,加热容易恢复颜色;
故答案为:受热均匀,易于控制温度; 品红溶液先褪色,加热后又恢复红色;
Ⅱ要检验生成的气体含有氢气,则应该先除去反应生成的二氧化硫,二氧化硫为酸性氧化物,可以用氢氧化钠溶液吸收,然后用浓硫酸干燥剩余气体,再将剩余气体通入盛有氧化铜的硬质试管中加热,如果有氢气存在则反应生成水,能够使白色的无水硫酸铜变蓝,
故答案为:①吸收SO2;干燥H2,防止干扰后面H2的检验;②无水CuSO4粉末.
点评:本题考查了氯气、二氧化硫、浓硫酸的性质,题目综合性强,熟悉物质的性质和实验的常识是解题关键,题目难度中等.

练习册系列答案
 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案
相关题目
下列变化属于氧化还原反应的是( )
| A、BaCl2+Na2S04═BaS04↓+2NaCl | ||||
B、2H2+02
| ||||
C、NH4HC03
| ||||
D、CaC03
|
实验室中制备HClO溶液的最好方法是将Cl2缓慢通入( )
| A、蒸馏水 | B、烧碱溶液 |
| C、纯碱溶液 | D、石灰石的悬浊液 |
 实验室用乙醇和浓硫酸加热反应制取乙烯,其原理为:
实验室用乙醇和浓硫酸加热反应制取乙烯,其原理为: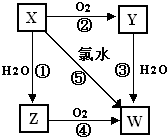 已知X气体是一种无色有刺激性气味的酸性氧化物,有关X、Y、Z、W的转化
已知X气体是一种无色有刺激性气味的酸性氧化物,有关X、Y、Z、W的转化