题目内容
【题目】硫化氢的转化是资源利用和环境保护的重要研究课题。由硫化氢获得硫单质有多种方法。
(1)已知:H2S(g)+H2SO4(aq)=S(s)+SO2(g)+2H2O(l) ΔH1=61kJ·mol-1
SO2(g)+I2(g)+2H2O(l)=2HI(aq)+H2SO4(aq) ΔH2=-151kJ·mol-1
2HI(aq)=H2(g)+I2(g) ΔH3=110kJ·mol-1
则硫化氢气体分解为氢气和固体硫的热化学方程式为___。
(2)K2CO3溶液吸收H2S的反应为K2CO3+H2S![]() KHS+KHCO3,该反应的平衡常数的对数值为lgK=___
KHS+KHCO3,该反应的平衡常数的对数值为lgK=___
(已知:H2CO3lgK1=-6.4,lgK2=-10.3;H2SlgKl=-7.0,lgK2=-19.0)。
(3)工业上采用图1所示装置电解K4[Fe(CN)6]和KHCO3混合溶液一段时间,然后停止电解,通入H2S,利用生成的K3[Fe(CN)6]将H2S转化为S,自身转化为K4[Fe(CN)6]。
①电解时,阳极的电极反应式为___。
②通入H2S过程中,伴有CO![]() 转化为HCO
转化为HCO![]() 。通H2S发生反应的离子反应方程式为___。
。通H2S发生反应的离子反应方程式为___。

(4)将含H2S尾气的空气按一定流速通入酸性FeCl3溶液中,可实现含H2S尾气的空气脱硫。在FeCl3溶液吸收H2S的过程中,溶液中的n(Fe3+)及被吸收的n(H2S)随时间t的变化如图2所示。t1时刻后,溶液中n(Fe3+)保持微量减少至基本不变,其原因是___。

(5)H2S溶液中H2S、HS-,S2-的物质的量分数δ(X)随pH的变化如图3所示,H2S的电离平衡常数Ka1=___。写出pH由12.0变为16.0时发生的主要的离子方程式:___。

【答案】H2S(g)=H2(g)+S(s) ΔH=20kJ·mol-1 3.3 [Fe(CN)6]4--e-=[Fe(CN)6]3- 2[Fe(CN)6]3-+2CO![]() +H2S=2[Fe(CN)6]4-+2HCO
+H2S=2[Fe(CN)6]4-+2HCO![]() +S↓ t1时刻后,生成的Fe3+与H2S发生氧化还原反应,溶液中的Fe2+被空气氧化为Fe3+,这两个反应的速率近似相等,因而溶液中的Fe3+的量基本不变 10-7.24 HS-+OH-=S2-+H2O
+S↓ t1时刻后,生成的Fe3+与H2S发生氧化还原反应,溶液中的Fe2+被空气氧化为Fe3+,这两个反应的速率近似相等,因而溶液中的Fe3+的量基本不变 10-7.24 HS-+OH-=S2-+H2O
【解析】
(1)已知①H2S(g)+H2SO4(aq)=S(s)+SO2(g)+2H2O(l) ΔH1=61kJ·mol-1;
②SO2(g)+I2(g)+2H2O(l)=2HI(aq)+H2SO4(aq) ΔH2=-151kJ·mol-1;
③2HI(aq)=H2(g)+I2(g) ΔH3=110kJ·mol-1
根据盖斯定律,反应①+②+③得H2S(g)=H2(g)+S(s),ΔH=ΔH1+ΔH2+ΔH3=20kJ·mol-1,故答案为:H2S(g)=H2(g)+S(s) ΔH=20kJ·mol-1;
(2)根据题意,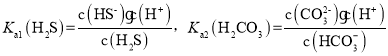 ,K2CO3溶液吸收H2S的反应为K2CO3+H2S
,K2CO3溶液吸收H2S的反应为K2CO3+H2S![]() KHS+KHCO3,离子方程式为
KHS+KHCO3,离子方程式为![]() +H2S
+H2S![]() HS-+
HS-+![]() ,则该反应的平衡常数为
,则该反应的平衡常数为 ,则lgK=lgKa1(H2S)-lgKa2(H2CO3)=-7-(-10.3)=3.3,故答案为:3.3;
,则lgK=lgKa1(H2S)-lgKa2(H2CO3)=-7-(-10.3)=3.3,故答案为:3.3;
(3)①电解时阳极发生失电子的氧化反应,先将[Fe(CN)6]4-转化为Fe(CN)6]3-,化合价升高,所以反应为:Fe(CN)6]4--e-=[Fe(CN)6]3-,故答案为:Fe(CN)6]4--e-=[Fe(CN)6]3-;
②通入H2S过程中,伴有CO![]() 转化为HCO
转化为HCO![]() ,根据电子得失守恒和元素守恒可知:2[Fe(CN)6]3-+2
,根据电子得失守恒和元素守恒可知:2[Fe(CN)6]3-+2![]() +H2S=2Fe[(CN)6]4-+2
+H2S=2Fe[(CN)6]4-+2![]() +S↓,故答案为:2[Fe(CN)6]3-+2
+S↓,故答案为:2[Fe(CN)6]3-+2![]() +H2S=2Fe[(CN)6]4-+2
+H2S=2Fe[(CN)6]4-+2![]() +S↓;
+S↓;
(4)t1时刻后,溶液中的Fe2+被空气氧化为Fe3+,生成的Fe3+再与H2S发生氧化还原反应,因而溶液中的Fe3+的量基本不变,故答案为:t1时刻后,生成的Fe3+与H2S发生氧化还原反应,溶液中的Fe2+被空气氧化为Fe3+,这两个反应的速率近似相等。因而溶液中的Fe3+的量基本不变;
(5)根据H2S溶液中H2S、HS-,S2-的物质的量分数δ(X)随pH的变化图,当pH=7.24时,c(H2S)=c(HS-),则H2S的电离平衡常数Ka1=c(H+)=10-7.24,由图可知,pH由12.0变为16.0时,是由HS-转化为了S2-,反应的离子方程式为HS-+OH-=S2-+H2O,故答案为:10-7.24;HS-+OH-=S2-+H2O。

 阅读快车系列答案
阅读快车系列答案