题目内容
15.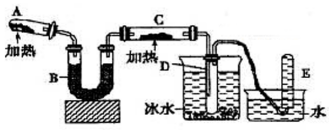 己知氨可以与灼热的氧化铜反应得到氮气和金属铜,用示意图中的装置可以实现该反应.
己知氨可以与灼热的氧化铜反应得到氮气和金属铜,用示意图中的装置可以实现该反应.回答下列问题:
(1)A中生成氨气反应的化学方程式是2NH4Cl+Ca(OH)2═CaCl2+2NH3↑+2H2O;
(2)B中加入的干燥剂是③(填序号)①浓硫酸②无水氯化钙③碱石灰;
(3)能证明氨与氧化铜反应的现象:①C中黑色粉末逐渐变为红色、②D中有无色液体生成;
设计实验检验D中无色液含有水:取少量液体于试管中,加入少量无水硫酸铜粉末,现象为白色固体变蓝.
(4)写出氨气与氧化铜反应的化学方程式2NH3+3Cu$\frac{\underline{\;\;△\;\;}}{\;}$N2+3H2O+3Cu.若收集到2.24L(STP)氮气,计算转移电子数为6mol.
分析 (1)氯化铵与氢氧化钙在加热的条件下反应生成氯化钙、水和氨气;
(2)氨气为碱性气体,应选择碱性干燥剂;
(3)氨气语言铜发生氧化还原反应,将氧化铜还原为铜;无水硫酸铜与水反应生成蓝色的五水硫酸铜;
(4)氨气和氧化铜在加热的条件下发生反应生成金属铜、水以及氮气;反应总氨气中-3价的氮化合价升高氮气中的0价,生成1mol氮气,失去6mol电子.
解答 解:(1)依据题中生成氨气的反应原理可知,氯化铵与氢氧化钙在加热的条件下反应生成氯化钙、水和氨气,化学方程式为:2NH4Cl+Ca(OH)2 $\frac{\underline{\;\;△\;\;}}{\;}$CaCl2+2NH3↑+2H2O;
故答案为:2NH4Cl+Ca(OH)2 $\frac{\underline{\;\;△\;\;}}{\;}$CaCl2+2NH3↑+2H2O;
(2)氨气能够与浓硫酸、氯化钙反应,不能用浓硫酸、氯化钙干燥,氨气为碱性气体,应选择碱性干燥剂,碱石灰为碱性干燥剂,可以干燥氨气;
故答案为:③;
(3)氨气和氧化铜在加热的条件下发生反应生成金属铜、水以及氮气,反应现象是:黑色粉末逐渐变为红色;白色的无水硫酸铜与水反应生成蓝色的五水硫酸铜,通常用无水硫酸铜检验水的存在;
故答案为:黑色粉末逐渐变为红色;白色固体变蓝;
(4)氨气和氧化铜在加热的条件下发生反应生成金属铜、水以及氮气,方程式:2NH3+3Cu$\frac{\underline{\;\;△\;\;}}{\;}$N2+3H2O+3Cu,反应总氨气中-3价的氮化合价升高氮气中的0价,生成1mol氮气,失去6mol电子;
故答案为:2NH3+3Cu$\frac{\underline{\;\;△\;\;}}{\;}$N2+3H2O+3Cu;6mol.
点评 本题考查学生氨气的实验室制法、干燥以及氨气的还原性方面的知识,结合实验来考查,增加了难度.

 名校课堂系列答案
名校课堂系列答案| A. | 0.01mol/L CH3COOH溶液 | B. | 0.01mol/L HNO3溶液 | ||
| C. | pH=2的H2SO4溶液 | D. | pH=2的CH3COOH溶液 |
| A. | 常温下硫的氧化物都是气体,通入水中都形成强酸 | |
| B. | 将FeCl3滴入饱和H2S溶液中,溶液的pH降低 | |
| C. | 将CO2通入CaSO4溶液中,无明显现象 | |
| D. | 充分利用含硫矿物,既可实现资源的有效利用,还可减轻酸雨污染 |
| A. | 绿矾一FeSO4•7H2O | B. | 芒硝一Na2SO4•10H2O | ||
| C. | 明矾一Al(SO4)3•12H2O | D. | 胆矾一CuSO4•5H2O |
①太阳光催化分解水制氢:2H2O(l)=2H2(g)+O2(g)△H1=+571.6kJ•mol-1
②甲烷与水反应制氢:CH4(g)+H2O(g)=CO(g)+3H2(g)△H2=+206.1kJ•mol-1
③焦炭与水反应制氢:C(s)+H2O(g)=CO(g)+H2(g)△H3=+131.3kJ•mol-1 .
| A. | 反应①中电能转化为化学能 | |
| B. | 反应②使用催化剂,△H2减小 | |
| C. | 反应③中反应物的总能量高于生成物的总能量 | |
| D. | 反应CH4(g)=C(s)+2H2(g)的△H=+74.8kJ•mol-1 |

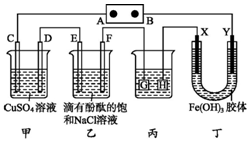 如图装置所示,C、D、E、F、X、Y都是惰性电极,甲、乙中溶液的体积和浓度都相同(假设通电前后溶液体积不变),A、B为外接直流电源的两极.将直流电源接通后,F极附近呈红色.
如图装置所示,C、D、E、F、X、Y都是惰性电极,甲、乙中溶液的体积和浓度都相同(假设通电前后溶液体积不变),A、B为外接直流电源的两极.将直流电源接通后,F极附近呈红色.