题目内容
某实验小组用燃烧分析法测定某有机物中碳和氢等元素的含量,随后又对其进行了性质探究。将已称量的样品置于氧气流中,用氧化铜作催化剂,在高温条件下样品全部被氧化为水和二氧化碳,然后分别测定生成的水和二氧化碳。实验可能用到的装置如下图所示,其中A装置可以重复使用。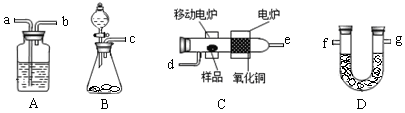
请回答下列问题:
(1)请按气体流向连接实验装置 → → →d→ → → → g(用仪器接口编号填写)。
(2)B装置中制O2时所用的药品是 。实验中,开始对C装置加热之前,要通一段时间的氧气,目的是 ;停止加热后,也要再通一段时间的氧气,目的是 。
(3)已知取2.3g的样品X进行上述实验,经测定A装置增重2.7g,D装置增重4.4g。试推算出X物质的实验式 。 (4)该小组同学进一步实验测得:2.3g的 X与过量金属钠反应可放出560mLH2(已换算成标准状况下),且已知X分子只含一个官能团。查阅资料后,学生们又进行了性质探究实验:
(4)该小组同学进一步实验测得:2.3g的 X与过量金属钠反应可放出560mLH2(已换算成标准状况下),且已知X分子只含一个官能团。查阅资料后,学生们又进行了性质探究实验:
实验一:X在一定条件下可催化氧化最终生成有机物Y.
实验二:X与Y在浓硫酸加热条件下生成有机物Z.
则①写出实验二中反应的化学方程式 。
②除去Z中混有的Y所需的试剂和主要仪器是 、 。
(5)若已知室温下2.3g液态X在氧气中完全燃烧生成二氧化碳气体和液态水时可放出68.35kJ的热量,写出X在氧气中燃烧的热化学方程式 。
(1)(c→a→b)→d→(e→a→b)→g (2分)
(2)H2O2和MnO2或Na2O2和H2O;(1分)
排出装置中的二氧化碳和水蒸气等;(2分)
将燃烧生成的二氧化碳和水蒸气彻底排出 (2分)
(3)C2H6O(2分)
(4)①CH3COOH + C2H5OH CH3COOC2H5 + H2O(2分)
CH3COOC2H5 + H2O(2分)
②饱和Na2CO3溶液、分液漏斗 (各1分)
(5)2C2H5OH(l)+3O2(g)= 2CO2(g)+3H2O(l);△H="-1367" kJ/mol(2分)
解析试题分析:(1)结合实验目的,分析装置图须将制得的氧气中的杂质气体出去,在氧化铜的催化下反应的产物需先吸收水,在吸收二氧化碳,则气流顺序(c→a→b)→d→(e→a→b)→g,
(3)A中2.7g为水,D中4.4g为二氧化碳,确定2.3g样品中H的质量为0.3g,C的质量为1.2g,O的质量为0.8g,从而样品的化学式为 C2H6O。
考点:实验、酯化反应、热化学方程式的书写。

 优翼小帮手同步口算系列答案
优翼小帮手同步口算系列答案乙酸乙酯是一种用途广泛的精细化工产品。某课外小组设计实验室制取并提纯乙酸乙酯的方案如下:
已知:①氯化钙可与乙醇形成CaCl2·6C2H5OH
②有关有机物的沸点:
| 试剂 | 乙醚 | 乙醇 | 乙酸 | 乙酸乙酯 |
| 沸点/℃ | 34.7 | 78.5 | 118 | 77.1 |
③2CH3CH2OH
 CH3CH2OCH2CH3+H2O
CH3CH2OCH2CH3+H2O I.制备过程
装置如图所示,A中放有浓硫酸,B中放有9.5mL无水乙醇和6mL冰醋酸,D中放有饱和碳酸钠溶液。
(1)写出乙酸与乙醇发生酯化反应的化学方程式 。
(2)实验过程中滴加大约3mL浓硫酸,B的容积最合适的是 (填入正确选项前的字母)
A.25mL B.50mL C.250mL D.500mL
(3)球形干燥管的主要作用是 。
(4)预先向饱和Na2CO3溶液中滴加几滴酚酞试液,目的是
。
Ⅱ.提纯方法:①将D中混合液转入分液漏斗进行分液。
②有机层用5mL饱和食盐水洗涤,再用5mL饱和氯化钙溶液洗涤,最后用水洗涤。有机层倒入一干燥的烧瓶中,用无水硫酸镁干燥,得粗产物。
③将粗产物蒸馏,收集77.1℃的馏分,得到纯净干燥的乙酸乙酯。
(5)第①步分液时,选用的两种玻璃仪器的名称分别是 、 。
(6)第②步中用饱和食盐水、饱和氯化钙溶液、最后用水洗涤,分别主要洗去粗产品中的 , , 。
已知某醇燃料含有碳、氢、氧三种元素。为了测定这种燃料中碳和氢两种元素的质量比,可将气态燃料放入足量的氧气中燃烧,并使产生的气体全部通入如图所示的装置,得到如下表所列的实验结果(假设产生的气体完全被吸收):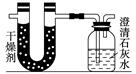
| | 实验前 | 实验后 |
| (干燥剂+U形管)的质量 | 101.1 g | 102.9 g |
| (石灰水+广口瓶)的质量 | 312.0 g | 314.2 g |
根据实验数据求:
(1)实验完毕后,生成物中水的质量为________ g,
假设广口瓶里生成一种正盐,其质量为________ g;
(2)生成的水中氢元素的质量为________ g;
(3)生成的二氧化碳中碳元素的质量为________ g;
(4)该燃料中碳元素与氢元素的质量比为________;
(5)已知这种醇的每个分子中含有一个氧原子,则该醇的分子式为__________,结构简式为_______________________________。
乙烯是来自石油的重要有机化工原料,其产量通常用来衡量一个国家的石油化工发展水平。结合以下路线回答:
已知: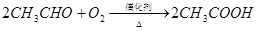
(1)反应II的化学方程式是 。
(2)D为高分子化合物,可以用来制造多种包装材料,其结构简式是 。
(3)E是有香味的物质,在实验室用下图装置制取。
①反应IV的化学方程式是 ,该反应类型为 。
②该装置图中有一个明显的错误是 。
(4)为了证明浓硫酸在反应IV中起到了催化剂和吸水剂的作用,某同学利用上图改进后装置进行了以下4个实验。实验开始先用酒精灯微热3min,再加热使之微微沸腾3min。实验结束后充分振荡小试管乙再测有机层的厚度,实验记录如下:
| 实验编号 | 试管甲中试剂 | 试管乙中试剂 | 有机层的厚度/cm |
| A | 2 mL乙醇、1 mL乙酸、 1mL18mol·L-1浓硫酸 | 饱和Na2CO3溶液 | 3.0 |
| B | 2 mL乙醇、1 mL乙酸 | 0.1 | |
| C | 2 mL乙醇、1 mL乙酸、 3 mL 2mol·L-1 H2SO4 | 0.6 | |
| D | 2 mL乙醇、1 mL乙酸、盐酸 | 0.6 |
①实验D的目的是与实验C相对照,证明H+对酯化反应具有催化作用。实验D中应加入盐酸的体积和浓度分别是3mL和 mol·L-1。
②分析实验 (填实验编号)的数据,可以推测出浓H2SO4的吸水性提高了乙酸乙酯的产率。
下列物质在一定条件下,可与苯发生化学反应的是 ( )
| A.水 | B.溴水 | C.浓硝酸 | D.酸性高锰酸钾溶液 |

 ,它可通过不同化学反应分别制得B、C和D三种物质.
,它可通过不同化学反应分别制得B、C和D三种物质.

