题目内容
向明矾[KAl(SO4)2.12H2O]溶液中加入Ba(OH)2溶液,当SO42- 恰好沉淀完全时,这时铝元素的存在形式是
| A.Al(OH)3沉淀 | B.只有AlO2- 离子 |
| C.Al(OH)3沉淀和Al3+ | D.Al(OH)3沉淀和〔AlO2〕-离子 |
B
解析试题分析:向明矾[KAl(SO4)2.12H2O]溶液中加入Ba(OH)2溶液,当SO42- 恰好沉淀完全时发生反应:Al3++ 2SO42-+ 2Ba2++4OH-= 2BaSO4↓+2H2O+ AlO2-.因此这时铝元素的存在形式AlO2- 离子。故选项为B。
考点:考查离子反应及离子的存在形式的知识。

练习册系列答案
 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案
相关题目
下列有关物质的性质和该性质的应用均正确的是
| A.SiO2具有较好的导电性,可用于制造半导体材料 |
| B.H2O2是一种绿色氧化剂,可氧化酸性高锰酸钾而产生O2 |
| C.铜的金属活动性比铁弱,可用铜罐代替铁罐贮运浓硝酸 |
| D.Mg在空气中燃烧发出耀眼的白光,可用于制作信号弹 |
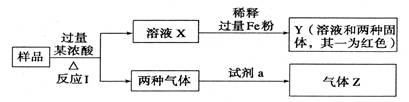
强酸X的转化关系如图: 图中单质可能为( )
图中单质可能为( )
| A.C | B.Fe | C.Al | D.Cu |
Cu、Cu2O和CuO组成的混合物加入100 mL 0.6 mol/L HNO3溶液,恰好使混合物溶解,同时收集到224 mL NO气体(标准状况)。下列说法不正确的是
| A.产物中硝酸铜的物质的量为0.025 mol |
| B.若混合物中Cu的物质的量为0.005 mol,则其中Cu2O、CuO的物质的量共0.020 mol |
| C.若混合物中含0.01 mol Cu,则其中Cu2O、CuO的物质的量均为0.005 mol |
| D.混合物中Cu的物质的量的取值范围为0.005 mol<n(Cu)<0.015 mol |
有4.8 g CuO、Fe2O3混合物跟足量CO充分反应后固体减少1.28 g,反应后全部气体用0.6 mol·L-1 Ba(OH)2溶液100 mL吸收。下列有关叙述中正确的是
| A.原混合物中CuO与Fe2O3物质的量的比为1∶2 |
| B.原混合物中CuO与Fe2O3的质量比为2∶1 |
| C.吸收CO2后溶液中一定有Ba(HCO3)2 |
| D.反应中生成的CO2体积为1.792 L |
某研究小组通过实验探究Cu及其化合物的性质,下列操作正确且能达到目的的是
| A.将铜丝插入浓硫酸中加热,反应后把水加入反应器中,观察硫酸铜溶液的颜色 |
| B.常温下将铜丝伸入盛满氯气的集气瓶中,观察CuCl2的生成 |
| C.将CuCl2溶液在蒸发皿中加热蒸干,得到无水CuCl2固体 |
| D.将表面有铜绿[Cu2(OH)2CO3]的铜器放入盐酸中浸泡,除去铜绿 |
对于实验Ⅰ~Ⅳ的实验现象预测正确的是
| A.实验Ⅰ:逐滴滴加盐酸时,试管中立即产生大量气泡 |
| B.实验Ⅱ:充分振荡后静置,下层溶液为橙红色,上层无色 |
| C.实验Ⅲ:从饱和食盐水中提取NaCl晶体 |
| D.装置Ⅳ:酸性KMnO4溶液中有气泡出现,且溶液颜色会逐渐变浅直至褪去 |
下列有关铝及其化合物的叙述正确的是 ( )。
| A.铝粉与氧化镁共热可制取金属镁 |
| B.足量铝分别与含1 mol HCl、1 mol NaOH的溶液反应,产生相同量的氢气 |
| C.工业上用电解熔融Al2O3的方法冶炼铝 |
| D.在浓硝酸中加入等体积的浓硫酸后,立即加入铝片,铝片表面发生钝化 |