题目内容
某研究小组通过实验探究Cu及其化合物的性质,下列操作正确且能达到目的的是
| A.将铜丝插入浓硫酸中加热,反应后把水加入反应器中,观察硫酸铜溶液的颜色 |
| B.常温下将铜丝伸入盛满氯气的集气瓶中,观察CuCl2的生成 |
| C.将CuCl2溶液在蒸发皿中加热蒸干,得到无水CuCl2固体 |
| D.将表面有铜绿[Cu2(OH)2CO3]的铜器放入盐酸中浸泡,除去铜绿 |
D
解析

练习册系列答案
 寒假乐园北京教育出版社系列答案
寒假乐园北京教育出版社系列答案
相关题目
下列陈述和判断均正确,且有因果关系的是( )
| 选项 | 陈述 | 判断 |
| A | Si有良好的半导体性能 | Si可用于制备光导纤维 |
| B | 在未知溶液中加入稀硝酸和氯化钡溶液有沉淀生成 | 说明该未知溶液含有SO42- |
| C | 铁、铜、汞、银的金属活动性顺序为Fe>(H)>Cu>Hg>Ag | 要从矿石中冶炼得到金属单质,铁和铜必须用还原剂,汞和银只需加热 |
| D | 锌锰干电池碳棒是正极,MnO2是氧化剂 | 锌锰干电池是二次电池,可以反复充电 |
从石器、青铜器到铁器时代,金属的冶炼体现了人类文明的发展水平。如图表示了三种金属被人类开发利用的大致年限。之所以有先后,主要取决于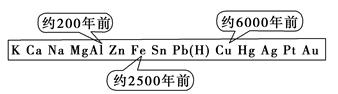
| A.金属的化合价高低 | B.金属的活动性大小 |
| C.金属的导电性强弱 | D.金属在地壳中的含量多少 |
已知:Li与Mg、Be与Al的性质相似。下列判断正确的是
| A.LiOH是强碱 |
| B.Be与冷水剧烈反应 |
| C.Li在空气中不易被氧化 |
| D.Be(OH)2能与NaOH溶液反应 |
向明矾[KAl(SO4)2.12H2O]溶液中加入Ba(OH)2溶液,当SO42- 恰好沉淀完全时,这时铝元素的存在形式是
| A.Al(OH)3沉淀 | B.只有AlO2- 离子 |
| C.Al(OH)3沉淀和Al3+ | D.Al(OH)3沉淀和〔AlO2〕-离子 |
在稀硫酸中加入铜粉,铜粉不溶解,再加入某X物质,发现铜粉逐渐溶解,问神秘的X不可能是( )
| A.FeCl3 | B.HNO3 | C.HCl | D.KNO3 |
某化学教师为“氯气与金属钠的反应”设计了如图所示的装置(加热装置省略)来替代相关的课本实验装置。先给钠预热,当钠熔化成圆球时,撤火,通入氯气,即可观察到钠着火燃烧,并产生大量白烟。
下列叙述错误的是( )
| A.钠着火燃烧产生苍白色火焰 |
| B.反应生成的大量白烟是氯化钠晶体 |
| C.管中部塞一团浸有NaOH溶液的棉花球是用于吸收过量的氯气,以免其污染空气 |
| D.根据管右端棉花球的颜色变化可判断氯气是否被NaOH溶液完全吸收 |
用铝热法还原下列氧化物制得金属各1 mol,消耗铝最少的是
| A.MnO2 | B.WO3 | C.Cr2O3 | D.Co3O4 |
向某晶体的溶液中加入含Fe2+的溶液无明显变化,当滴加几滴溴水后,混合液出现红色,由此得出下列的结论错误的是 ( )。
| A.Fe3+的氧化性比溴的氧化性强 |
| B.该晶体中一定含有SCN- |
| C.Fe2+与SCN-不能形成红色化合物 |
| D.Fe2+被溴氧化成Fe3+ |