题目内容
下列有关铝及其化合物的叙述正确的是 ( )。
| A.铝粉与氧化镁共热可制取金属镁 |
| B.足量铝分别与含1 mol HCl、1 mol NaOH的溶液反应,产生相同量的氢气 |
| C.工业上用电解熔融Al2O3的方法冶炼铝 |
| D.在浓硝酸中加入等体积的浓硫酸后,立即加入铝片,铝片表面发生钝化 |
C
解析

练习册系列答案
 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案
相关题目
向明矾[KAl(SO4)2.12H2O]溶液中加入Ba(OH)2溶液,当SO42- 恰好沉淀完全时,这时铝元素的存在形式是
| A.Al(OH)3沉淀 | B.只有AlO2- 离子 |
| C.Al(OH)3沉淀和Al3+ | D.Al(OH)3沉淀和〔AlO2〕-离子 |
足量的二氧化碳通入到1mol/L NaOH溶液中,下列说法错误的是
| A.溶液中Na+离子个数为NA(NA表示阿伏加德罗常数) |
| B.溶液中的CO32—离子浓度先增大后减小 |
| C.微热反应后的溶液,溶液的pH会升高 |
| D.当恰好生成Na2CO3时,溶液中离子浓度大小存在以下关系: |
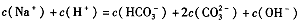
下列陈述Ⅰ、Ⅱ均正确并且有因果关系的是
| 选项 | 陈述Ⅰ | 陈述Ⅱ |
| A | Fe2O3是红棕色粉末 | Fe2O3常用作红色涂料 |
| B | SiO2是两性氧化物 | SiO2可和HF反应 |
| C | Al2O3难溶于水 | Al2O3可用作耐火材料 |
| D | SO2有氧化性 | SO2可使溴水褪色 |
硝酸铜是一种重要的工业产品,化学上有很多方法可以制取硝酸铜:①将铜溶于硝酸中、②先将铜与O2反应生成CuO,再溶于硝酸中、③将铜溶于N2O4的乙酸乙酯(溶剂,不参加反应)溶液中生成硝酸铜和一氧化氮。下列认识或判断错误的是( )。
| A.方法③是最经济和环保的 |
| B.方法①中,若从经济和环保的角度考虑,用稀硝酸比用浓硝酸好 |
| C.方法②需要消耗能源,对环境不产生污染 |
| D.方法③中N2O4既是氧化剂又是还原剂 |
下列关于钠及其化合物的说法正确的是( )。
| A.将金属钠投入水中,再经过一步转化可得碳酸氢钠 |
| B.分别向Na2CO3和NaHCO3溶液中滴加少量盐酸,产生CO2较快的为NaHCO3 |
| C.等物质的量的Na2O2、NaHCO3在密闭容器中加热,反应后得到的产物为纯净物 |
| D.钠与O2反应时,由于O2的量不同,可分别生成Na2O或Na2O2 |
向某晶体的溶液中加入含Fe2+的溶液无明显变化,当滴加几滴溴水后,混合液出现红色,由此得出下列的结论错误的是 ( )。
| A.Fe3+的氧化性比溴的氧化性强 |
| B.该晶体中一定含有SCN- |
| C.Fe2+与SCN-不能形成红色化合物 |
| D.Fe2+被溴氧化成Fe3+ |
从海水中提取镁的工艺流程可表示如下: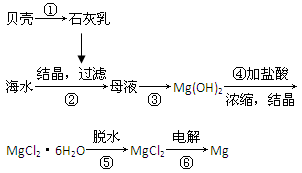
下列说法不正确的是( )。
| A.用此法提取镁的优点之一是原料来源丰富 |
| B.步骤⑥电解MgCl2时阴极产生氯气 |
| C.步骤⑤可将晶体置于HCl气体氛围中脱水 |
| D.上述工艺流程中涉及化合、分解和复分解反应 |
X、Y、Z分别是三种常见的金属或非金属单质, M、N、R是常见的三种氧化物。其中一种具有高熔点,而且有如下反应(条件未标出,方程未配平):(1)X+Z→N;(2)M+X→N;(3)M+Y→R+X 。若X是非金属,则组成Y单质的元素在周期表中的位置是( )
| A.第二周期ⅣA族 | B.第三周期ⅡA族 |
| C.第二周期ⅥA族 | D.第三周期ⅣA族 |