题目内容
【题目】某化学兴趣小组研究混有少量氯化钠杂质的纯碱样品,设计如下装置来测定该纯碱样品的纯度。实验步骤如下:
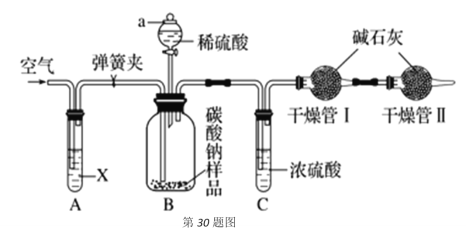
①组装好仪器并检查气密性;
②用托盘天平称量干燥管Ⅰ的质量为m1;
③称量纯碱样品的质量为n,装入广口瓶B内;
④打开分液漏斗a的旋塞,缓缓滴入稀硫酸,至不再产生气泡为止;
⑤往试管A缓缓鼓入空气数分钟,然后称量干燥管Ⅰ的质量为m2。
请回答:
(1)试剂X是__________,写出广口瓶B中反应的化学方程式__________。
(2)干燥管Ⅱ的作用是__________。
(3)步骤④若滴入稀硫酸过快,会导致测定结果__________(填“偏大”、“偏小”或者“不变”);理由是__________。
(4)根据此实验,计算纯碱样品纯度的为__________(用含m1、m2、n的代数式表示)。
【答案】氢氧化钠溶液 H2SO4 + Na2CO3== Na2SO4 +CO2↑ + H2O 防止空气中的CO2和H2O被干燥管Ⅰ吸收,影响实验 偏小 一部分CO2来不及被吸收 ,导致CO2质量偏小 ![]() 100%
100%
【解析】
(1)试剂X是吸收空气中的二氧化碳,装置B中稀硫酸与碳酸钠反应的发生装置;
(2)实验利用干燥管I中的固体质量变化来测定生成的二氧化碳的质量,干燥管Ⅱ在干燥管I之后是为了防止空气中的气体进入装置干扰实验,据此分析;
(3)步骤④若滴入稀硫酸过快,反应不够充分,生成的二氧化碳质量偏小;
(1)要测定二氧化碳的质量,需排除空气中二氧化碳对生成的二氧化碳的质量的影响,除去二氧化碳使用的是氢氧化钠溶液;装置B中稀硫酸与碳酸钠反应生成二氧化碳与硫酸钠和水,其化学方程式为:H2SO4 + Na2CO3== Na2SO4 +CO2↑ + H2O,
故答案为:氢氧化钠溶液;H2SO4 + Na2CO3== Na2SO4 +CO2↑ + H2O;
(2)干燥管Ⅱ在干燥管I之后,能阻止空气中的二氧化碳和水进入干燥管I,造成误差,
故答案为:防止空气中的CO2和H2O被干燥管Ⅰ吸收,影响实验;
(3) 步骤④若滴入稀硫酸过快,一部分CO2来不及被吸收,导致CO2质量偏小,
故答案为:偏小;一部分CO2来不及被吸收 ,导致CO2质量偏小;
(4)根据所测数据,生成二氧化碳的质量为(m2-m1),设碳酸钠的质量为x,则有
H2SO4 + Na2CO3== Na2SO4 +CO2↑ + H2O
106 44
x m2-m1
![]()
x=![]() ×(m2-m1)
×(m2-m1)
所以纯碱样品纯度为:![]() 100%
100%
故答案为:![]() 100%。
100%。

 阅读快车系列答案
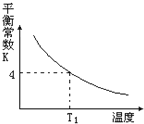
阅读快车系列答案【题目】T2℃时,将1 mol X和2 mol Y投入2L的密闭容器中,发生反应:X(g)+2Y(g)![]() 3Z(g)ΔH,测得X、Y的量随时间变化如下表,平衡时物质X的体积分数为φ,该反应的平衡常数(K)随温度的变化如下图,则下列判断正确的是
3Z(g)ΔH,测得X、Y的量随时间变化如下表,平衡时物质X的体积分数为φ,该反应的平衡常数(K)随温度的变化如下图,则下列判断正确的是
0 | 1 | 2 | 3 | 4 | 5 | 6 | |
X | 1 | 0.80 | 0.66 | 0.58 | 0.52 | 0.50 | 0.50 |
Y | 2 | 1.60 |
A. 前5 min用Z表示的平均反应速率为1.2mol/(L·min)
B. T2℃时,对于反应1/2X(g)+Y(g)![]() 3/2Z(g) △H’ 2ΔH’=ΔH
3/2Z(g) △H’ 2ΔH’=ΔH
C. T2℃时,若以1mol X、2mol Y和1mol Z充入上述容器中,达到平衡时X的体积分数比φ大
D. 该反应的正反应是吸热反应,且T1<T2


