题目内容
实验室有一瓶可能含有NaCl、Na2SO4、KNO3、K2CO3、K2SO4中的一种或几种杂质的Na2SO3,通过下列实验确定该样品的成分及Na2SO3的质量分数。 称取样品
请根据实验填写以下空白:

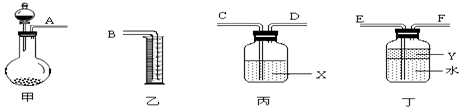
(1)若用上图所示仪器组装进行上述实验,气流从左到右,各仪器的正确连接顺序为______接 , 接 , 接 ;X溶液是 ,汽油的作用是 。
(2)操作时,怎样才能正确地测出放出气体的体积?
(3)若实验中加入硫酸溶液的体积为5.00mL,则样品中Na2SO3的质量分数是 ,一定含有的杂质是 (通过计算回答)。
解析:(1)仪器连接顺序应遵循:制气→干燥净化→排液→收集。
(2)测量气体体积必须保证同温同压,可通过上下移动量筒及正确读数实现。

焰色反应实验说明无钾盐。
![]()
而H2SO4电离出的![]() 物质的量为:
物质的量为:
6.0mol·L-1×
说明原样品中有0.01molNa2SO4。
而0.025molNa2SO3、0.01molNa2SO4的质量之和小于
答案:(1)A E F D C B 浓硫酸 防止SO2溶于水
(2)视线与量筒内液面持平;上下移动量筒使其液面与广口瓶中液面相平。
(3)50.0% Na2SO4、NaCl

练习册系列答案
 精英口算卡系列答案
精英口算卡系列答案
相关题目