题目内容
13.下列有关NaClO和NaCl混合溶液的叙述正确的是( )| A. | 该溶液中,H+、NH4+、SO42-、Br-可以大量共存 | |
| B. | 该溶液中,Ag+、K+、NO3-可以大量共存 | |
| C. | 向该溶液中滴入少量FeSO4溶液,反应的离子方程式为:2Fe2++ClO-+2H+═Cl-+2Fe3++H20 | |
| D. | 向该溶液中加入浓盐酸,每产生1molCl2,转移电子约为6.02×1023个 |
分析 A.酸性条件下,ClO-、Br-能发生氧化还原反应;
B.Ag+、Cl-发生反应生成沉淀;
C.酸性条件下,Fe2+、ClO-发生氧化还原反应;
D.加入浓盐酸,发生反应方程式为NaClO+2HCl=NaCl+Cl2↑+H2O,根据氯气和转移电子之间关系计算.
解答 解:A.酸性条件下,ClO-、Br-能发生氧化还原反应生成氯离子和溴单质而不能大量共存,故A错误;
B.Ag+、Cl-发生反应生成沉淀AgCl而不能大量共存,故B错误;
C.NaClO为强碱弱酸盐,水解呈碱性,NaCl为中性,溶液中不存在大量的氢离子,离子方程式为2Fe 2++ClO-+H2O=Fe 3++Fe(OH)3↓+Cl-,故C错误;
D.加入浓盐酸,发生反应方程式为NaClO+2HCl=NaCl+Cl2↑+H2O,根据方程式知,每生成1mol氯气转移电子数约为6.02×1023个,故D正确;
故选D.
点评 本题考查氧化还原反应有关知识,涉及离子共存、离子方程式书写、根据方程式计算等知识点,明确离子性质及离子共存条件、离子方程式书写规则等即可解答,易错选项是D.

练习册系列答案
相关题目
6.下列使用漏斗的几个实验装置中,设计正确且能达到实验目的是( )


| A. | 用图甲所示装置制取并收集少量的N02气体(不考虑倒吸) | |
| B. | 用图乙所示装置制取并收集氨气 | |
| C. | 用图丙所示装置用苯萃取碘水中的碘,并将碘的苯溶液从漏斗下口放出 | |
| D. | 用图丁所示装置配制一定物质的量浓度的溶液 |
1.有关pH计算结果一定正确的是 ( )
①强酸pH=a,加水稀释到10n倍,则pH=a+n;
②弱酸pH=a,加水稀释到10n倍,则pH<a+n(a+n<7);
③强碱pH=b,加水稀释到10n倍,则pH=b-n;
④弱碱pH=b,加水稀释到10n倍,则pH>b-n(b-n>7).
①强酸pH=a,加水稀释到10n倍,则pH=a+n;
②弱酸pH=a,加水稀释到10n倍,则pH<a+n(a+n<7);
③强碱pH=b,加水稀释到10n倍,则pH=b-n;
④弱碱pH=b,加水稀释到10n倍,则pH>b-n(b-n>7).
| A. | ①② | B. | ②③ | C. | ③④ | D. | ②④ |
8.下列说法正确的是( )
| A. | 可以用pH试纸来测定1mol•L-1硫酸溶液的pH | |
| B. | NH3可以使湿润的pH试纸变红 | |
| C. | 用广泛pH试纸测定某氢氧化钠溶液的pH为12.5 | |
| D. | 用干燥洁净的玻璃棒蘸取待测液,滴到pH试纸上,再和标准比色卡对照 |
5.二氧化硫与氧气的反应为:2SO2(g)+O2(g)?2SO3(g);△H<0,如对此反应升温,V正V逆变化正确的是( )
| A. | V正减小,V逆增大 | B. | V正增大,V逆减小 | C. | V正V逆都增大 | D. | V正V逆都减小 |

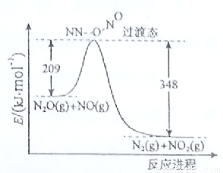
 4C(g)+D(g);△H<0.在一定温度、压强下达到平衡.平衡时C的物质的量与加入的B的物质的量的变
4C(g)+D(g);△H<0.在一定温度、压强下达到平衡.平衡时C的物质的量与加入的B的物质的量的变 化关系如图.下列说法正确的是( )
化关系如图.下列说法正确的是( )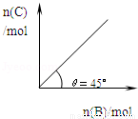
 .
.