题目内容
有10g不纯CaCO3样品与足量盐酸作用后生成4.44g CO2,且溶液中残留难溶物质.则对于此样品中是否存在①MgCO3②K2CO3③SiO2杂质的判断正确的是( )
| A、肯定含①③,不含② |
| B、肯定含①③,可能含② |
| C、肯定含②③,不含① |
| D、肯定含②③,可能含① |
考点:化学方程式的有关计算,有关混合物反应的计算
专题:计算题
分析:不纯的碳酸钙样品与足量盐酸反应后,溶液中残留有不溶物,说明样品中含有不能与盐酸发生反应且不溶于水的固体物质,可判断样品中一定含有③SiO2杂质;
假设10g样品全部为碳酸钙,完全反应后产生二氧化碳质量为4.4g,小于实际产生二氧化碳4.44g,说明还含有与盐酸反应可以生成二氧化碳的杂质,且相同质量的该杂质比碳酸钙生成的二氧化碳多.
假设10g样品全部为碳酸钙,完全反应后产生二氧化碳质量为4.4g,小于实际产生二氧化碳4.44g,说明还含有与盐酸反应可以生成二氧化碳的杂质,且相同质量的该杂质比碳酸钙生成的二氧化碳多.
解答:
解:不纯的碳酸钙样品与足量盐酸反应后,溶液中残留有不溶物;而①MgCO3②K2CO3③SiO2等杂质中只有③SiO2不能与盐酸发生反应,因此,样品中一定含有③SiO2;
假设10g样品全部为碳酸钙,其物质的量为0.1mol,完全反应后产生二氧化碳质量为0.1mol×44g/mol=4.4g,小于实际产生二氧化碳4.44g,说明还含有与盐酸反应可以生成二氧化碳的杂质,且相同质量的该杂质比碳酸钙生成的二氧化碳多,由下列的关系式:
CaCO3~CO2 MgCO3~CO2 K2CO3~CO2
100 44 84 44 138 44
可知等质量的碳酸钙、碳酸镁、碳酸钾与足量盐酸放出二氧化碳的质量由大到小的关系为:MgCO3>CaCO3>K2CO3,故还一定含有的杂质为MgCO3,
综上所述,不纯的碳酸钙样品中一定含有①MgCO3和③SiO2,可能含有②K2CO3;
故选B.
假设10g样品全部为碳酸钙,其物质的量为0.1mol,完全反应后产生二氧化碳质量为0.1mol×44g/mol=4.4g,小于实际产生二氧化碳4.44g,说明还含有与盐酸反应可以生成二氧化碳的杂质,且相同质量的该杂质比碳酸钙生成的二氧化碳多,由下列的关系式:
CaCO3~CO2 MgCO3~CO2 K2CO3~CO2
100 44 84 44 138 44
可知等质量的碳酸钙、碳酸镁、碳酸钾与足量盐酸放出二氧化碳的质量由大到小的关系为:MgCO3>CaCO3>K2CO3,故还一定含有的杂质为MgCO3,
综上所述,不纯的碳酸钙样品中一定含有①MgCO3和③SiO2,可能含有②K2CO3;
故选B.
点评:本题考查混合物计算,侧重考查学生分析解决问题的能力,等质量的碳酸盐与足量酸反应放出二氧化碳的质量关系可通过对比碳酸盐中碳酸根的含量,碳酸根含量大放出二氧化碳气体多.

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目
实验室用密度为1.84g/cm3 98%的浓硫酸与密度为1.1g/cm3 15%的稀硫酸混合配制密度为1.4g/cm3 59%的硫酸溶液,取浓、稀硫酸的体积比最接近的值是( )
| A、1:2 | B、2:1 |
| C、3:2 | D、2:3 |
下列关于乙醇的说法正确的是( )
| A、常温下是一种无色无味的液体 |
| B、能和乙酸发生加成反应 |
| C、能和Na2CO3溶液反应 |
| D、可发生氧化反应 |
下列除去杂质所选用的试剂或方法完全正确的是( )
| A、除去NaCl溶液中的少量I2:用无水乙醇,萃取分液 |
| B、除去CO2中少量HCl:通入饱和Na2CO3溶液,洗气 |
| C、除去NaHCO3固体中少量Na2CO3:加热灼烧 |
| D、除去FeCl2溶液中的少量FeCl3:加入足量铁屑,充分反应后,过滤 |
下列各分子中所有原子都满足最外层为8电子结构的是( )
| A、BeCl2 |
| B、PCl3 |
| C、PCl5 |
| D、H2S |
“信息”、“材料”和“能源”被称为新科技革命的三大支柱.下列说法错误的是( )
| A、在即将到来的新能源时代,核能、太阳能、氢能将可能成为主要能源 |
| B、开发太阳能、氢能等新型能源有利于减少二氧化碳的排放量 |
| C、煤的气化技术是减少二氧化碳排放的重要措施 |
| D、煤的“气化”和“液化”技术可提高煤的综合利用效率 |
 大气臭氧层的分解反应时O3(g)+O(g)═2O2(g)△H,该反应的能量变化如图所示,已知氯原子对O3分解的催化原理为O3(g)+Cl(g)═ClO(g)+O2(g)△H1,ClO(g)+O(g)═Cl(g)+O2(g)△H2.下列判断正确的是( )
大气臭氧层的分解反应时O3(g)+O(g)═2O2(g)△H,该反应的能量变化如图所示,已知氯原子对O3分解的催化原理为O3(g)+Cl(g)═ClO(g)+O2(g)△H1,ClO(g)+O(g)═Cl(g)+O2(g)△H2.下列判断正确的是( )| A、△H=E2-E3 |
| B、E1-E3=△H1+△H2 |
| C、氯原子可使E1减少 |
| D、2O2═O3+O是吸热反应 |
下列对有机物结构或性质的描述中错误的是( )
| A、一定条件下,Cl2可在甲苯的苯环或侧链上发生取代反应 |
| B、乙烷和丙烯的物质的量共1mol,完成燃烧生成3mol H2O |
| C、用水可区分苯和溴苯 |
D、如图中有机物的一氯代物有4种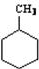 |
下列离子或分子组中能大量共存,且满足相应要求的是( )
| A、K+、AlO2-、Cl-、MnO4- 要求:无色澄清溶液 |
| B、Fe3+、NO3-、I-、HCO3- 要求:逐滴滴加盐酸立即有气体产生 |
| C、Na+、Al3+、Cl-、SO42- 逐滴滴加NaOH先有沉淀产生,后沉淀消失 |
| D、NH4+、Mg2+、SO42-、CH3COOH 要求:滴加NaOH浓溶液立刻又气体产生 |