题目内容
【题目】A、B、C、D、E、F六种短周期主族元素,它们的原子序数依次增大;A是周期表中原子半径最小的元素;B元素的最高价氧化物的水化物与其简单氢化物能相互反应生成盐;C元素原子的最外层电子数是内层电子数的3倍;D元素的主族序数等于其周期数;E元素原子的最外层电子数是其电子层数的2倍.G单质是日常生活中用量最大的金属,易被腐蚀. 试回答下列问题:
(1)A元素的同位素有(写原子符号)
(2)实验室制取B的简单氢化物的化学反应方程式为
(3)C,D,E,F的简单离子半径由大到小的顺序是(用离子符号表示)
(4)用化学事实说名E与F这两种元素非金属性的强弱(举一例)
(5)下列有关G的说法不正确的是 A、铁位于第四周期ⅧB族,在人体内的血红蛋白中含有铁元素
B、过量的铁分别与氯气和稀盐酸反应所得氯化物相同
C、FeCl3、FeCl2、Fe(OH)3都可以通过化合反应制取
D、氢氧化铁与HI溶液仅发生中和反应
(6)向NaOH溶液中通入一定量的F单质,两者恰好完全反应,生成物中有三种含F的离子,其中两种离子的物质的量与反应时间的曲线如图所示.请写出t2时反应的总的化学方程式 . 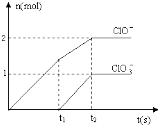
【答案】
(1)1H、2H、3H
(2)2NH4Cl+Ca(OH)2 ![]() CaCl2+2NH3↑+2H2O
CaCl2+2NH3↑+2H2O
(3)S2﹣>Cl﹣>O2﹣>Al3+
(4)H2O比H2S稳定
(5)A、B、D
(6)5Cl2+10NaOH=7NaCl+2NaClO+NaClO3+5H2O
【解析】解:A、B、C、D、E、F 六种短周期元素,它们的原子序数依次增大,A是周期表中原子半径最小的元素,则A为H元素;B元素的最高价氧化物的水化物与其氢化物能相互反应生成盐,则B为N元素;C元素原子的最外层电子数是其内层电子数的3倍,原子只能有2个电子数,最外层电子数为6,故C为O元素;D元素的主族序数等于其周期数,原子序数大于氧,只能处于第三周期,故D为Al;E元素原子的最外层电子数是其电子层数的2倍,原子序数大于Al,处于第三周期,最外层电子数为6,故E为S元素;G单质是日常生活中用量最大的金属,易被腐蚀,则G为Fe.(1)A为H元素,其同位素有:1H、2H、3H,所以答案是:1H、2H、3H;(2)B的简单氢化物为NH3 , 实验室制取氨气的化学反应方程式:2NH4Cl+Ca(OH)2 ![]() CaCl2+2NH3↑+2H2O,所以答案是:2NH4Cl+Ca(OH)2
CaCl2+2NH3↑+2H2O,所以答案是:2NH4Cl+Ca(OH)2 ![]() CaCl2+2NH3↑+2H2O;(3)电子层结构相同,核电荷数越大离子半径越小,电子层越多离子半径越大,故离子半径:S2﹣>Cl﹣>O2﹣>Al3+ , 所以答案是:S2﹣>Cl﹣>O2﹣>Al3+;(4)水比硫化氢稳定等可以说明氧元素非金属性比硫的强,所以答案是:H2O比H2S稳定;(5)A.在人体内的血红蛋白中含有铁元素,铁位于第四周期Ⅷ族,故A错误;B.过量的铁与氯气反应生成氯化铁,而Fe与稀盐酸反应生成氯化亚铁,故B错误;C.氯气与Fe反应生成FeCl3 , Fe与氯化铁反应生成FeCl2 , 氢氧化亚铁氧化生成Fe(OH)3 , 都可以通过化合反应制取,故C正确;D.铁离子具有强氧化性,可以氧化碘离子,氢氧化铁与HI溶液发生中和反应外,还发生氧化还原反应,故D错误,故选:ABD;(6)根据图象知,次氯酸根离子的物质的量为0.2mol,氯酸根离子的物质的量为0.1mol,根据电子转移守恒可知生成氯离子为
CaCl2+2NH3↑+2H2O;(3)电子层结构相同,核电荷数越大离子半径越小,电子层越多离子半径越大,故离子半径:S2﹣>Cl﹣>O2﹣>Al3+ , 所以答案是:S2﹣>Cl﹣>O2﹣>Al3+;(4)水比硫化氢稳定等可以说明氧元素非金属性比硫的强,所以答案是:H2O比H2S稳定;(5)A.在人体内的血红蛋白中含有铁元素,铁位于第四周期Ⅷ族,故A错误;B.过量的铁与氯气反应生成氯化铁,而Fe与稀盐酸反应生成氯化亚铁,故B错误;C.氯气与Fe反应生成FeCl3 , Fe与氯化铁反应生成FeCl2 , 氢氧化亚铁氧化生成Fe(OH)3 , 都可以通过化合反应制取,故C正确;D.铁离子具有强氧化性,可以氧化碘离子,氢氧化铁与HI溶液发生中和反应外,还发生氧化还原反应,故D错误,故选:ABD;(6)根据图象知,次氯酸根离子的物质的量为0.2mol,氯酸根离子的物质的量为0.1mol,根据电子转移守恒可知生成氯离子为 ![]() =0.7mol,所以次氯酸根离子、氯酸根离子、氯离子的物质的量之比为2:1:7,t2时氯气和氢氧化钠的反应方程式为:5Cl2+10NaOH=7NaCl+2NaClO+NaClO3+5H2O,所以答案是:5Cl2+10NaOH=7NaCl+2NaClO+NaClO3+5H2O.
=0.7mol,所以次氯酸根离子、氯酸根离子、氯离子的物质的量之比为2:1:7,t2时氯气和氢氧化钠的反应方程式为:5Cl2+10NaOH=7NaCl+2NaClO+NaClO3+5H2O,所以答案是:5Cl2+10NaOH=7NaCl+2NaClO+NaClO3+5H2O.

 天天练口算系列答案
天天练口算系列答案【题目】如表中评价合理的是( )
选项 | 化学反应及其离子方程式 | 评价 |
A | 铁与稀盐酸反应: | 正确 |
B | 大理石溶于醋酸的反应: | 错误,醋酸应写为分子形式CH3COOH,CaCO3应写成离子形式 |
C | FeCl3溶液“腐蚀”铜箔: | 正确 |
D | NH4HCO3溶液与过量NaOH浓溶液共热:NH4++OH﹣ | 错误,HCO3﹣也可以与OH﹣反应 |
A.A
B.B
C.C
D.D

