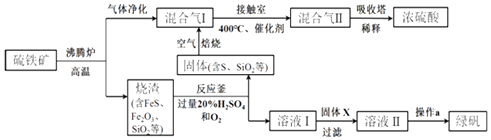
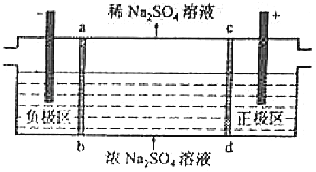
题目内容
【题目】有A、B、C、D、E五种元素,A元素形成的﹣2价阴离子比氦的核外电子数多8个.B元素的一种氧化物为淡黄色固体,该固体遇到CO2能生成A的单质.C为原子核内有12个中子的二价金属,当2.4g C与足量盐酸反应时,生成标准状况下的H2 2.24L.D的原子M层上有7个电子,E与A同周期且最外层比次外层多3个电子.回答下列问题.
(1)C离子的结构示意图
(2)A、E氢化物的稳定性比较(填化学式)
(3)A,B,C,D四种离子半径由大到小顺序(用离子符号表示).
(4)用电子式表示C与D形成化合物的形成过程: .
(5)写出D单质与B的最高价氧化物对应水化物反应的离子方程式: .
(6)写出Cu与E的最高价氧化物对应水化物稀溶液反应的化学方程式: .
【答案】
(1)
(2)H2O>NH3
(3)Cl﹣>O2﹣>Na+>Mg2+
(4)![]()
(5)2Al+2OH﹣+2H2O=2AlO2﹣+3H2↑
(6)3Cu+8HNO3=3Cu(NO3)2+2NO↑+4H2O
【解析】解:有A、B、C、D、E五种元素,A元素形成的﹣2价阴离子比氦的核外电子数多8个,则A的质子数为2+8﹣2=8,则A为氧元素;B元素的一种氧化物为淡黄色固体,该固体遇到CO2能生成A的单质,则B为Na元素,淡黄色固体为Na2O2;C为原子核内有12个中子的二价金属,当2.4gC与足量热水反应时,在标准状态下放出氢气2.24L,令C的相对原子质量为x,根据电子转移守恒,则 ![]() ×2=
×2= ![]() ×2,解得x=24,故C的质子数为24﹣12=12,则C为Mg元素;D的M层上有7个电子,则D为Cl元素;E与A同周期且最外层比次外层多3个电子,最外层电子数为5,故E为N元素.(1)C离子Mg2+ , 结构示意图为
×2,解得x=24,故C的质子数为24﹣12=12,则C为Mg元素;D的M层上有7个电子,则D为Cl元素;E与A同周期且最外层比次外层多3个电子,最外层电子数为5,故E为N元素.(1)C离子Mg2+ , 结构示意图为 ![]() ,所以答案是:
,所以答案是: ![]() ;(2)A、E氢化物分别为H2O、NH3 , 由于非金属性O>N,故稳定性:H2O>NH3 , 所以答案是:H2O>NH3;(3)电子层结构相同的离子,核电荷数越大离子半径越小,电子层越多离子半径越大,故离子半径:Cl﹣>O2﹣>Na+>Mg2+ , 所以答案是:Cl﹣>O2﹣>Na+>Mg2+;(4)由C和D所组成的化合物为MgCl2 , 用电子式表示形成过程为:
;(2)A、E氢化物分别为H2O、NH3 , 由于非金属性O>N,故稳定性:H2O>NH3 , 所以答案是:H2O>NH3;(3)电子层结构相同的离子,核电荷数越大离子半径越小,电子层越多离子半径越大,故离子半径:Cl﹣>O2﹣>Na+>Mg2+ , 所以答案是:Cl﹣>O2﹣>Na+>Mg2+;(4)由C和D所组成的化合物为MgCl2 , 用电子式表示形成过程为: ![]() , 所以答案是:
, 所以答案是: ![]() ;(5)D单质与B的最高价氧化物对应水化物反应的离子方程式:2Al+2OH﹣+2H2O=2AlO2﹣+3H2↑,
;(5)D单质与B的最高价氧化物对应水化物反应的离子方程式:2Al+2OH﹣+2H2O=2AlO2﹣+3H2↑,
所以答案是:2Al+2OH﹣+2H2O=2AlO2﹣+3H2↑;(6)Cu 与 E 的最高价氧化物对应水化物的稀溶液反应方程式:3Cu+8HNO3=3Cu(NO3)2+2NO↑+4H2O,
所以答案是:3Cu+8HNO3=3Cu(NO3)2+2NO↑+4H2O.

【题目】甲烷、一氧化碳和氢气、甲醇等既是重要的燃料也是重要的化工原料. 已知:
①2H2(g)+O2(g)═2H2O(l)△H1=﹣571.6kJmol﹣1
②CH4(g)+ ![]() O2(g)═CO(g)+2H2(g)△H2=﹣36kJmol﹣1
O2(g)═CO(g)+2H2(g)△H2=﹣36kJmol﹣1
③CH4(g)+H2O(g)═CO(g)+3H2(g)△H3=+216kJmol﹣1
(1)氢气的燃烧热为 , 写出甲烷不完全燃烧生成一氧化碳和液态水的热化学方程式: .
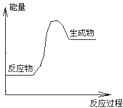
(2)现有1mol由H2O(g)与O2组成的混合气体,且O2的体积分数为x,将此混合气体与足量CH4充分反应.当x=时,反应②与③放出(或吸收)的总能量为0.若②反应过程中能量转化过程如图所示,下列有关说法中正确的是 . 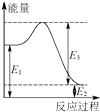
A.E1=36kJ B.E2=36kJ C.E1﹣E2=36kJ D.E3﹣E1=36kJ
(3)工业上可通过CO和H2化合制得CH3OH:CO(g)+2H2(g)=CH3OH(g)△H1(CO结构式为C≡O).又知某些化学键的键能(断开1mol化学键时所需要的最低能量)数值如表:
化学键 | C﹣C | C﹣H | H﹣H | C﹣O | C≡O | H﹣O |
键能 | 348 | 413 | 436 | 358 | 1072 | 463 |
则△H1= .