题目内容
【题目】把一定量的铁粉放入氯化铁溶液中,完全反应后,所得溶液中Fe2+和Fe3+的浓度恰好相等。则已反应的Fe3+和未反应的Fe3+的物质的量之比为
A.1∶1B.2∶1C.2∶3D.3∶2
【答案】C
【解析】
设已反应的Fe3+的物质的量为2mol,根据Fe+2Fe3+=3Fe2+,溶液中Fe2+的物质的量为3mol,因为溶液中的Fe3+和Fe2+浓度相等,所以未反应的Fe3+的物质的量为3mol,则已反应的Fe3+和未反应的Fe3+的物质的量之比为2mol∶3mol=2∶3,故选C。

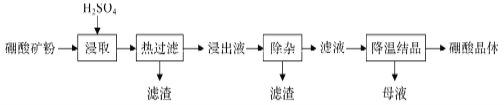
【题目】以硼镁矿(2MgO·B2O3·H2O、SiO2及少量Fe3O4、CaCO3、A12O3)为原料生产硼酸的工艺流程如下:
已知:表一:不同温度下H3BO3的溶解度
温度℃) | 20 | 40 | 60 | 100 |
溶解度(g) | 5.0 | 8.7 | 14.8 | 40.2 |
表二:不同物质沉淀完全时的pH
物质 | Fe(OH)3 | Al(OH)3 | Fe(OH)2 | Mg(OH)2 |
pH | 3.2 | 5.2 | 9.7 | 12.4 |
(1)由于矿粉中含CaCO3,“浸取”时容易产生大量泡沫使物料从反应器中溢出,应采取的措施为_________________________。
(2)“浸出液”显酸性,含有H3BO3、Mg2+和SO42-,还含有Fe2+、Fe3+、Ca2+、Al3+等杂质。“除杂”时,向浸出液中依次加入适量H2O2和MgO,可以除去的杂质离子为_______________________,H2O2的作用为_____________________(用离子方程式表示)。
(3)“浸取”后,采用“热过滤”的目的为__________________________。
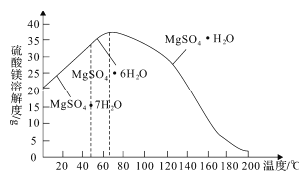
(4)“母液”可用于回收硫酸镁,已知硫酸镁的溶解度随温度变化的曲线如图所示,且溶液的沸点随压强增大而升高。为了从“母液”中充分回收MgSO4·H2O,应采取的措施是将“母液”蒸发浓缩,____________________________________。
(5)己知25℃时,硼酸(H3BO3)溶液中存在如下平衡:H3BO3![]() [B(OH)4]-(aq)+H+(aq);K=5.7×10-10;25℃时,0.7mol·L-1硼酸溶液中c(H+)=__________mol·L-1。
[B(OH)4]-(aq)+H+(aq);K=5.7×10-10;25℃时,0.7mol·L-1硼酸溶液中c(H+)=__________mol·L-1。
(6)已知25℃时:
化学式 | H2CO3 | CH3COOH |
电离常数 | K1=4.4×10-7 K2=4.7×10-11 | K=1.75×10-5 |
下列说法正确的是________(填选项字母)。
a.碳酸钠溶液滴入硼酸溶液中能观察到有气泡产生
b.碳酸钠溶液滴入醋酸溶液中能观察到有气泡产生
c.等浓度碳酸溶液和硼酸溶液的pH:前者>后者
d.等浓度碳酸钠溶液和醋酸钠溶液的pH:前者>后者
【题目】根据下列实验现象,所得结论正确的是( )

实验 | 实验现象 | 结论 |
A | 左烧杯中铁表面有气泡,右边烧杯中铜表面有气泡 | 氧化性:Al3+>Fe2+>Cu2+ |
B | 左边棉花变为橙色,右边棉花变为蓝色 | 氧化性:Cl2>Br2>I2 |
C | 右烧杯中澄清石灰水变浑浊,左边烧杯中无明显变化 | 热稳定性:Na2CO3>NaHCO3 |
D | 锥形瓶中有气体产生,烧杯中液体变浑浊 | 非金属性:Cl>C>Si |


