题目内容
【题目】(1)把一块纯净的锌片插入盛有稀硫酸的烧杯里,可观察到锌片逐渐溶解,并有气体产生;再平行地插入一块铜片(如图甲所示),可观察到铜片上____(填“有”或“没有”)气泡产生;再用导线把锌片和铜片连接起来(如图乙所示),可观察到铜片上____(填“有”或“没有”)气泡产生。
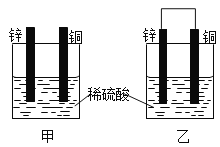
(2)图乙是一个将_____能转化为 _____能的装置,人们把它叫做原电池。外电路中的电子是从_____电极流向______电极。
(3)图乙中的电极反应式:锌片________;铜片______。
【答案】没有 有 化学 电 锌 铜 Zn - 2e- = Zn 2+ 2 H++ 2e- = H2↑
【解析】
(1)由于金属活动性顺序表中铜排在氢后面,所以铜不和稀硫酸反应;在原电池中,产生气泡的极只能是正极;
(2)原电池是将化学能转化为电能的装置;原电池中电子从负极出发经过外电路到达正极;
(3)锌比铜活泼,锌为负极,被氧化,发生Zn-2e-═Zn2+,铜为正极,发生还原反应,电极方程式为2H++2e-═H2↑。
(1)将铜插到硫酸中,金属铜不能和酸反应置换出氢气,再用导线把锌片和铜片连接起来,会形成Zn、Cu、硫酸原电池,在正极上氢离子得电子产生氢气;
答案:没有 有
(2)图乙用导线把锌片和铜片连接起来,与电解质溶液形成闭合回路,即形成了原电池,原电池是将化学能转化为电能的装置;活泼金属锌为负极失电子,铜为正极,溶液中氢离子得电子,电子从负极(锌)出发经过外电路到达正极(铜);
答案:化学 电能 锌 铜
(3)Zn、Cu、硫酸原电池中,活泼金属锌做负极,电极反应为:Zn-2e-=Zn2+,金属铜做正极,电极反应为:2H++2e-=H2↑;
答案:Zn - 2e- = Zn 2+ 2 H+ + 2e- = H2↑




