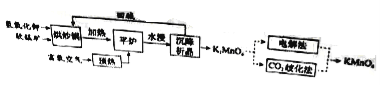
题目内容
【题目】次磷酸(H3PO2)是一种精细化工产品,具有较强还原性,回答下列问题:
(1)H3PO2是一元中强酸,写出其电离方程式:______________________。
(2)H3PO2及NaH2PO2均可将AgNO3溶液中的Ag+ 还原为银,从而可用于化学镀银。
①H3PO2中,磷元素的化合价为______。
②利用H3PO2进行化学镀银反应中,氧化剂与还原剂的物质的量之比为4:1,写出该反应的化学方程式,并在方程式中用单线桥表示该反应的电子转移:_______。
③NaH2PO2为____________ (填“正盐”或“酸式盐”)。
【答案】H3PO2![]() H++H2PO2- +1
H++H2PO2- +1 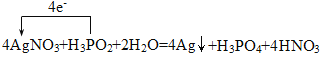 正盐
正盐
【解析】
(1)H3PO2是一元中强酸,则电离时,只能电离出一个H+,且反应物与生成物间用“![]() ”连接。
”连接。
(2)① H3PO2中,H显+1价,O显-2价,依据化合物中各元素化合价的代数和为0,求出磷元素的化合价。
② 利用H3PO2进行化学镀银反应中,氧化剂与还原剂的物质的量之比为4:1,该反应氧化剂为AgNO3,还原剂为H3PO2,产物为Ag、H3PO4,H3PO4是由得失电子守恒得出,再根据质量守恒,添加其它的反应物和生成物;单线桥表示的电子转移是从反应物中失电子元素指向反应物中的得电子元素。
③ 因为H3PO2是一元中强酸,所以NaH2PO2为正盐。
(1)H3PO2是一元中强酸,则电离时,只能电离出一个H+,电离方程式为H3PO2![]() H++H2PO2-。答案为:H3PO2
H++H2PO2-。答案为:H3PO2![]() H++H2PO2-;
H++H2PO2-;
(2)① H3PO2中,H显+1价,O显-2价,依据化合物中各元素化合价的代数和为0,磷元素的化合价为+1价。答案为:+1;
② 利用H3PO2进行化学镀银反应中,氧化剂与还原剂的物质的量之比为4:1,该反应氧化剂为AgNO3,还原剂为H3PO2,产物为Ag、H3PO4,H3PO4是由得失电子守恒得出,再根据质量守恒,添加其它的反应物和生成物,反应的化学方程式为4AgNO3+H3PO2+2H2O=4Ag+H3PO4+4HNO3;单线桥表示的电子转移方向和数目为:
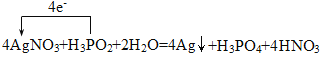
答案为: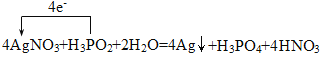
③ 因为H3PO2是一元中强酸,所以NaH2PO2为正盐。答案为:正盐。

 全优考典单元检测卷及归类总复习系列答案
全优考典单元检测卷及归类总复习系列答案 品学双优卷系列答案
品学双优卷系列答案【题目】由A、B、C、D四种金属按下表中装置进行实验。
装置 |
|
|
|
现象 | 二价金属A不断溶解 | C的质量增加 | A上有气体产生 |
根据实验现象回答下列问题:
(1)装置甲中负极的电极反应式是______________________________________。
(2)装置乙中正极的电极反应式是_______________________________________。
(3)装置丙中溶液的pH________(填“变大”、“变小”或“不变”)。
(4)四种金属活动性由强到弱的顺序是___________________________________。
【题目】研究硫元素及其化合物的性质具有重要意义。
(1)25 ℃,在0.10 mol·L-1H2S溶液中,通入HCl气体或加入NaOH固体以调节溶液pH,溶液pH与[S2-]关系如下图(忽略溶液体积的变化、H2S的挥发)。
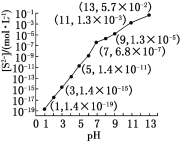
①pH=13时,溶液中的[H2S]+[HS-]=__________mol·L-1。
②某溶液含0.020 mol·L-1Mn2+、0.10 mol·L-1H2S,当溶液pH=____________时,Mn2+开始沉淀[已知:Ksp(MnS)=2.8×10-13]。
(2)25 ℃,两种酸的电离平衡常数如下表。
物质 | Ka1 | Ka2 |
H2SO3 | 1.3×10-2 | 6.3×10-8 |
H2CO3 | 4.2×10-7 | 5.6×10-11 |
①HSO的电离平衡常数表达式K=________。
②0.10 mol·L-1Na2SO3溶液中离子浓度由大到小的顺序为____________________。
③H2SO3溶液和NaHCO3溶液反应的主要离子方程式为_________________________。